Гормонотерапия при раке простаты
Гормонотерапия при раке простаты ещё несколько лет назад была предпочтительным методом лечения пожилых мужчин и даже при раннем раке составляла конкуренцию радикальным способам — хирургии и лучевой терапии.
Недавнее изучение эффективности адъювантного (профилактического) эндокринного воздействия показало, что ведущий критерий гарантированной результативности гормонотерапии — низкий уровень ПСА не оправдал клинических надежд, а стандартные показания к использованию гормональных средств при раке простаты нуждаются в коррекции.
Что такое гормональная терапия?
С онкологической позиции гормональная терапия — подавление продукции стимулирующих рост и развитие рака собственных гормонов или ограничение их доступа в раковые клетки. Науке неизвестно, что подвигает нормальные клетки предстательной железы к злокачественному перерождению, тем не менее в большинстве случаев у пожилых отмечается позитивный отвечает на гормональное воздействие. В противовес этому у молодых мужчин, доля которых неуклонно увеличивается, заболевание чаще не реагирует на блокаду гормонального воздействия. Ранее не отзывавшуюся на гормональное влияние карциному предстательной железы называли гормонорефрактерной, сегодня отдано предпочтение термину «кастрационно-рефрактерный рак».
Ведущий механизм лечебного эндокринного воздействия при раке простаты — снижение уровня тестостерона в клетках железы за счёт уменьшения его продукции яичками или блокадой его проникновения внутрь клетки.
Лечение рака простаты гормонотерапией
Гормонотерапия не считается радикальным воздействием, то есть неспособна излечить от злокачественного заболевания, но на длительный срок останавливает прогрессию опухоли.
- дополняет радикальную операцию, снижая вероятность рецидива заболевания при распространении ракового процесса в лимфоузлы, но на проценте выживаемости через 10 лет после хирургии, как выяснили исследования, отражается мало;
- используется до операции — неоадъювантно, позволяя уменьшить размеры первичного образования и лимфатических узлов при продвинутой стадии;
- предваряет и сопровождает дистанционное облучение и брахитерапию, общий срок применения в 3 года существенно улучшает общие результаты лечения;
- самостоятельно используется при метастатическом варианте или противопоказаниях к радикальным способам лечения, позволяя на годы продлить жизнь без тяжких симптомов болезни;
- используется вместе с химиотерапией, повышая результативность цитостатиков.
В качестве гормонального воздействия на разных этапах развития простатической карциномы в разных комбинациях можно использовать операцию и пять групп гормональных препаратов.
При простатической карциноме «золотой стандарт» эндокринного воздействия, с которым сравнивают все лекарственные методики, и одновременно самый «древний» — удаление обоих яичек или двусторонняя орхидэктомия. Пугающая пациентов операция одна из самых простых и самых результативных — снижение уровня тестостерона начинается уже во время хирургического вмешательства и через 12 часов в крови концентрация уже минимальна. К кастрации с помощью орхидэктомии прибегают при противопоказаниях к радикальной простатэктомии, для профилактики после операции на железе, при облучении и метастазах. Никакой другой способ не дает такого быстрого результата, эффективность применения достигает 85% без опасности формирования лекарственной устойчивости.
По результату хирургической кастрации равноценно использование синтетических агонистов выделяемого гипоталамусом лютеинизирующего гормона рилизинг-гормона или ЛГРГ. Агонист ЛГРГ запускает последовательную цепочку биохимических реакций, снижающих выработку тестостерона яичками, что позволило назвать процесс «медикаментозной кастрацией». Правда падение концентрации начинается не сразу, как при орхидэктомии, а только через 3-4 недели и после кратковременного повышения уровня тестостерона с очень неприятными для пациента проявлениями — синдрома вспышки, купируемого приёмом антиандрогенов. Агонист ЛГРГ вводится через каждые 28 дней, растворы трипторелина, бусерилина и лейпрорелина — внутримышечно, гозерилин — в брюшную стенку. Лечение проводится до развития устойчивости и только вместе с приёмом антиандрогенов.
Антагонисты ЛГРГ лишены синдрома вспышки, поскольку включаются в работу уже в гипофизе головного мозга, по эффективности не уступают другим методикам кастрации. Препарат дегареликс вводится только раз в месяц, но обладает неприятными побочными эффектами, самый частый из которых — сильная боль при подкожном введении.
Антиандрогены на поверхности раковой клетки связываются с рецептором, не допуская тестостерон внутрь, опосредовано снижая и выброс ЛГРГ. Представлены тремя нестероидными препаратами — бикалутамидом, нилутамидом и флутамидом, и тремя стероидами, из которых клиническое значением имеет только ципротерон. Различия в строении лекарств не влияют на эффективность, в отличии от спектра побочных реакций. Как правило, используются вместе с агонистами ЛГРГ или после хирургической кастрации, но не исключается и монотерапия. Лечение многолетнее и ежедневное, оптимальная суточная доза набирается за несколько приемов.
Эстрогены были первыми лекарствами в линейке эндокринного воздействия, точка их приложения — блокировка выработки ЛГ и ФСГ, что мешает выработке тестостерона. Эффект эстрогенов сравним с последствиями всех вариантов кастрации, но «первую скрипку» в эстрогенотерапии играет побочное повреждение сердечно-сосудистой системы, что переместило их во вторую линию терапевтического воздействия. Как оказалось, обременительные ежедневные внутримышечные инъекции диэтилстильбэстрола вредят сердцу и сосудам меньше более удобных таблеток.
К препаратам второго ряда отнесён аминоглютетимид, снижающий уровень выработки андрогенов надпочечниками, и требующий обязательного дополнительного приёма глюкокортикоидов для уменьшения побочных эффектов, самое опасное из которых — надпочечниковая недостаточность.

В каких случаях назначают гормонотерапию при раке простаты?
Гормональное лечение возможно при любой стадии рака простаты, как изолированно, так и вместе с радикальными подходами.
Профилактическое использование рекомендуется при высоком риске послеоперационного рецидива, что вероятно после удаления большой первичной опухоли и метастазах более чем в двух лимфоузлах, а также после радикальной лучевой терапии. Гормональные средства не нужны после удаления раннего рака невысокой степени агрессивности, такие пациенты и без дополнительного лечения имеют все шансы жить долго и навсегда забыть про рак.
Очень помогает высокой выживаемости без рецидива присоединение профилактической по задачам гормонотерапии к облучению, эндокринное воздействие продолжается 2-3 года. В качестве адъювантной может использоваться хирургическая кастрация или медикаментозная в комплексе с антиандрогенами, которые начинают принимать загодя — за неделю до агониста ЛГРГ, предотвращая неприятности синдрома вспышки.
Гормонотерапия пациентов с формально операбельным процессом без метастазов, но с тяжкими сопутствующими болезнями, препятствующими хирургии и облучению, позволяет избежать смерти от рака простаты.
При метастатической стадии рака простаты достойной альтернативы гормонам не существует, даже химиотерапия не показывает такой результативности, прогрессирование процесса останавливается на долгие годы и даже десятилетия, позволяя больному активно жить при минимальных проявлениях болезни.
При рецидиве рака простаты лекарственное лечение эндокринными препаратами проводится после облучения или в самостоятельном виде.
Следует уточнить, что даже при резистентном к гормональной терапии раке, дополнение антиандрогенов к химиотерапии помогает пациенту больше, чем одна химиотерапия.
Достоинства гормонотерапии
Достоинство гормональной терапии в её высокой эффективности, до настоящего времени клинические исследования не выявили самого лучшего препарата или комбинации, поэтому для каждого конкретного пациента можно подобрать оптимальное лечение с учётом сопутствующих болезней, доступности лечебного учреждения и финансов пациента.
Большое достоинство — простота использования пролонгированных форм агонистов и антагонистов ЛГРГ — раз в несколько недель. Таблетированные формы антиандрогенов не «привязывают» больного раком предстательной железы к медицинскому учреждению, как необходимость делать инъекции.
При равной эффективности всех групп гормональных средств неоспоримо достоинство самого доступного варианта — хирургической кастрации, когда «сделал и забыл» и не надо согласовывать график своей жизни с часами работы процедурного кабинета лечебного учреждения и справляться о наличии агониста или антагониста ЛГРГ в аптечном пункте.
Гормональное воздействие не свободно от побочных реакций, но в сравнении с другими методами лечения рака лучше переносится и не мешает активной жизни пациента.
Противопоказания
Гормонотерапия переносится хорошо большинством пациентов, что позволило её сделать альтернативой хирургической операции у очень пожилых или ослабленных хроническими болезнями пациентов.
Противопоказание для хирургической кастрации одно — психологический негатив больного мужчины.
Агонисты ЛГРГ противопоказаны в монорежиме при прогнозировании феномена вспышки — только вместе с антиандрогенами.
Эстрогенотерапия невозможна при заболеваниях сердца и сосудов.Исключается применение только одних антиэстрогенов при первичном раннем раке предстательной железы, поскольку существуют менее токсичные методики. Лучевая терапия при небольшой опухоли простаты, особенно брахитерапия, поможет полному избавлению от болезни, при полном противопоказании к облучению должно проводиться лечение комбинацией гормональных препаратов.
Возможные последствия
Гормональные препараты не столь токсичны, как принято считать, конечно же лечение ими не свободно от побочных реакций, но не таких ярких и тяжких, как последствия противоопухолевых цитостатиков.
Большинство реакций обусловлено снижением выработки половых гормонов, все препараты вызывают:
- импотенцию (эректильную дисфункцию)
- снижение полового влечения (либидо)
- нарушение жирового обмена с исходом в избыточный вес
- дисгормональный остеопороз
- приливы и увеличение молочных (грудных) желез — гинекомастию.
К таким последствиям в разном наборе и разной степени выраженности приводят и лекарства, и кастрация — хирургическая и медикаментозная.
Двусторонняя орхидэктомия исключает использование в дальнейшем одной современной методики лечения, снижающей токсические проявления — интермиттирующей андрогенной блокады, когда препараты даются не постоянно, а по схеме.
Антиандрогены неблагоприятно действуют на слизистую желудочно-кишечного тракта, почти также часто, как широко используемые с обезболивающей целью НПВС. Они снижают функциональные возможности печеночных клеток, способны ухудшить состояние сердечно-сосудистой системы, только стероидные препараты наносят урон за счёт эффекта, подобного действию прогестерона, а нестероидные — из-за повышения содержание тестостерона в крови. Наименее токсичный из одногруппников — бикалутамид, при его длительном приёме довольно редки повреждения желудочно-кишечного тракта, но со стороны грудных желез жалоб больше — увеличение их сопровождается болевым синдромом.
Эстрогены «богаты» токсическими реакциями, по частоте и интенсивности опережают все остальные препараты, а также вызывают тяжелые тромбозы. Всё это привело к переводу достаточно эффективных средств в разряд «вторичных», то есть применяемых при исчерпании эффективности лекарств всех остальных групп.
Прогноз и эффективность
Главное последствие гормонотерапии — существенное увеличение продолжительности жизни при практически полном купировании симптомов рака, ни одно злокачественное заболевание не имеет столь «мягкого» и столь долгого течения. Каждый третий пациент с 4 стадией рака с помощью гормонотерапии благополучно переживает первую пятилетку.
За время болезни почти каждому пациенту удаётся получить лечение практически всеми группами лекарственных средств, когда по мере прогрессирования одна линия сменяет другую. Большинству больных проводится не менее 4 комбинаций гормональной терапии — беспрецедентная возможность, недоступная страдающим другими злокачественными процессами.
У каждого шестого с отсутствием эффекта от кастрации приём одних только антиандрогенов позволяет достичь позитивного результата. При прогрессировании на фоне антиандрогенов у каждого третьего мужчины эстрогены способны остановить рост рака. После исчерпания эффекта гормонов остается альтернатива в виде химиотерапии.
Многое определяется возможностями клиники и искусством онкоурологов и химиотерапевтов, умело манипулирующими гормональными препаратами и симптоматическими средствами для купирования осложнений лечения, неизбежных при многолетнем противоопухолевом эндокринном воздействии. Всем пациентам нашей клиники мы помогаем жить активно, как можно лучше и дольше.
Лечение рака простаты гормональным методом
В 1941 г. Хаггинс и Ходжес выяснили, что почти все виды рака предстательной железы представляют собой гормонально зависимые опухоли. Оказалось, что назначение эстрогенов и орхиэктомию можно использовать в качестве паллиативных мер для больных с костными метастазами. Поскольку для большинства таких больных радикальный хирургический метод не подходит, в качестве стандартных методов лечения начальных и поздних случаев рака была выбрана гормональная терапия или орхиэктомия.
Одно время пользовался популярностью такой эстрогенный препарат как эстрамустин (комбинация эстрогена с остатком азотистого иприта в положении С-17), однако по своей эффективности он не превосходил диэтилстильбэстрол.
Как самостоятельный лечебный метод гормональная терапия используется на поздних стадиях рака предстательной железы (стадии III и IV). Некоторые онкологи предпочитают назначать больным в стадии III локальную лучевую терапию, в случае если у них отсутствуют метастазы и по клиническим показателям возможно радикальное лечение.
Новые схемы гормональной терапии рака предстательной железы существенным образом расширили выбор онкологов. Они отличаются друг от друга по своим возможностям и по характеру присущих им побочных эффектов. Однако остаются неясными вопросы, насколько существенно та или иная схема терапии влияет на эффективность лечения, обладает ли каким-либо преимуществом комбинированное применение препаратов по сравнению с изолированным или последовательным их назначением.
Аналоги гонадотропин-рилизинг-гормона, которые называются агонистами секреции лютеинизирующего гормона (ЛГ), влияют на секрецию гонадотропина, что приводит к снижению уровня тестостерона. Вначале происходит увеличение секреции ЛГ и фолликулостимулирующего гормона, которое через 1-2 недели приводит к падению содержания тестостерона до уровня, который обычно наблюдается после кастрации. Это происходит за счет десенсибилизации поверхностных рецепторов.
К числу таких препаратов относится гозерелин (золадекс), депонированная форма аналога гонадотропин-рилизинг-гормона, и флутамид — индивидуальный антиандроген, влияющий на связывание тестостерона с рецепторами андрогенов. Эти препараты, наряду с более традиционными формами гормональной терапии (производные эстрогенов, орхиэктомия), обладают примерно одинаковой эффективностью. В то же время, при применении аналоговых препаратов, наблюдается меньше осложнений со стороны сердца и сосудов, и они более эффективны, чем диэтилстильбэстрол. Флутамид по механизму действия близок к ацетату ципротерона. Последний давно получил широкое рапространение (1973 г.).
Аналоги LHRH вначале стимулируют, а затем подавляют высвобождение LH.
Это приводит к снижению выработки тестостерона яичками и к регрессии гормонально-зависимых опухолей простаты.
Одно из преимуществ флутамида и других антиандрогенов нестероидного типа перед стильбэстролом заключается в том, что после лечения ими у мужчин сораняется половая потенция. Однако препараты вызывают существенные побочные эффекты, такие как гинекомастия, а также функциональные расстройства печени и кишечника. Они быстро разрушаются в организме и поэтому назначаются в многократных ежедневных дозах. В отличие от аналога прогестерона ципротерон-ацетата, препараты не ингибируют секрецию ЛГ. Поскольку они блокируют механизм отрицательной обратной связи, количество тестостерона в сыворотке крови увеличивается.
Наблюдались больные, которым проводилась полная блокада андрогенов при назначении комбинации гормональных агентов, блокирующих секреторную функцию яичка и надпочечников. У больных с поздними стадиями рака предстательной железы наблюдался незначительный эффект. Обычно назначали комбинацию аналога гонадотропин-рилизинг-гормона с антиандрогеном флутамидом. В последнем наблюдении, проведенном EORTC на большом количестве больных с поздней стадией развития локальной опухоли, пациентам проводили максимальную андрогенную блокаду, после чего назначали курс внешнего облучения, а затем в продолжение 3 лет продолжали андрогенную блокаду. При этом увеличилась общая и безболезненная выживаемость больных.
Важную роль в лечении болезненных костных метастазов играет паллиативная лучевая терапия. Обычно метастазы чувствительны к умеренным дозам облучения. Поскольку они преимущественно возникают в нижнем отделе позвоночника, все больше практикуется однократное облучение нижней половины туловища. Доза 7,5-10 Гр снимает болевой синдром и хорошо переносится больными.
Если лечение эстрогенами или паллиативное облучение оказываются неэффективными у больных с распространенными метастазами, следует рассмотреть возможность проведения билатеральной орхиэктомии, которая в таких случаях часто дает благоприятный результат. К числу тяжелых относятся случаи рака предстательной железы, устойчивой к гормональной терапии. Прогноз выживаемости для таких больных крайне неблагоприятен, однако им необходимо проводить терапию, направленную на поддержание в организме дефицита андрогенов. При отмене антиандрогенной терапии увеличится уровень тестостерона, что приведет к снижению выживаемости среди таких больных. Особенно это проявляется в случаях, когда им назначались аналоги гонадотропинрилизинг-гормона.
Результаты химиотерапии рака предстательной железы оказываются достаточно разочаровывающими, хотя для таких препаратов, как циклофосфамид, метотрексат, 5-ФУ, митозантрон, таксаны, азотистый иприт и цисплатин, наблюдался небольшой эффект.
Для больных, испытывающих постоянные боли в костях, которые не удается снять трациционными процедурами, может оказаться полезным лечение радиоактивным фосфором. При этом улушение состояния отмечено у 75% больных, правда, эффект носит непродолжительный характер. Недавно на рынке появился Sr, который в наибольшей степени подходит для такой терапии, поскольку преимущественно захватывается метастазами. При этом исключается возможность переоблучения костного мозга.
Подводя краткий итог, приходим к выводу о том, что больные раком предстательной железы, в среднем, теряют почти 10 лет жизни. В Великобритании в настоящее время этот рак ежегодно уносит 9500 человеческих жизней.
Видео этиология, патогенез рака простаты
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гормональная терапия рака простаты
Гормональная терапия также называется андрогенной депривационной или андроген-супрессивной терапией. Цель лечения – снижение в крови уровня мужских гормонов (андрогенов), или предотвращение воздействия этих гормонов на раковые клетки простаты.
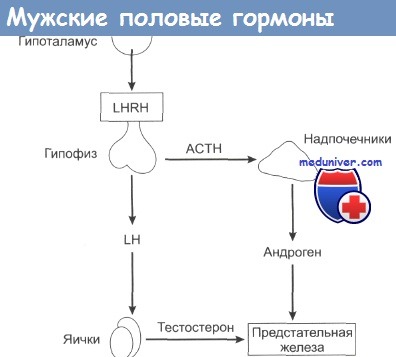
Основные мужские андрогены – это тестостерон и дигидротестостерон (ДГТ). Андрогены, вырабатываются в яичках, под контролем гипоталамо-гипофизарной системы.

Глядя на изображение выше, можно увидеть, что в гипоталамусе вырабатывается рилизинг гормон лютеинизирующего гормона (ЛГРГ), т.е. вещество, под воздействием которого в гипофизе высвобождается лютеинизирующий гормон (ЛГ). В свою очередь лютеинизирующий гормон стимулирует секрецию тестостерона в яичках. 90% тестостерона вырабатывается в яичках, лишь 10% – в надпочечниках. Тестостерон, достигая клеток предстательной железы, превращается в дигидротестостерон под воздействием фермента 5-альфа-редуктазы. Дигидротестостерон в десятки раз активнее тестостерона. Дигидротестостерон и тестостерон стимулируют рост раковых клеток. Содержащийся в крови фермент ароматаза превращает тестостерон в эстрогены. Циркулирующие в крови эстрогены и андрогены по принципу обратной связи подавляют выработку ЛГ и ЛГРГ гипоталамо-гипофизарной системой.
Снижение в крови уровня андрогенов или предотвращение их воздействия на клетки простаты, приводит к сморщиванию раковых клеток или замедлению их роста. Стоит знать, что одна гормонотерапия не может полностью вылечить рак простаты.
Гормональная терапия используется:
- Когда не может быть выполнена операция или проведена радиационная терапия, или когда рак распространился за пределы предстательной железы.
- Если произошло повторное развитие рака простаты (рецидив) после хирургического или радиационного лечения.
- В комбинации с радиационной терапией, как начальное лечение рака у мужчин с высоким риском рецидива после лечения (Основываясь на высоком индексе Глисона, высоком уровне ПСА и/или распространении опухоли за пределы железы).
- Перед радиационной терапией для повышения эффективности лечения.
- Перед операцией для уменьшения простаты в размере.
Типы гормональной терапии рака простаты:
1. Хирургическая кастрация – орхэктомия
Несмотря на то, что орхэктомия – это операция, ее основной эффект связан с гормональной перестройкой. Во время операции хирург удаляет яички, в которых вырабатывается 90% андрогенов. После удаления источника андрогенов со временем происходит снижение их концентрации в крови и остановка роста опухоли или ее сморщивание.
Орхэктомия – операция, которая может выполняться в амбулаторных условиях. Для достижения удовлетворительного косметического эффекта, удаленные яички могут заменяться искусственными имплантами. Хирургическая кастрация – наиболее легкий и дешевый способ снижения уровня андрогенов в крови.

2. Медикаментозная гормональная терапия рака простаты
В лечении рака простаты могут использоваться следующие группы препаратов:
- Аналоги, или агонисты рилизинг-гормона лютеинизирующего гормона (ЛГРГ)
Благодаря использованию этих препаратов достигается эффект аналогичный эффекту хирургической кастрации, т.е. происходит снижение уровня андрогенов в крови. Это так называемая медикаментозная кастрация. Суть действия аналогов ЛГРГ заключается в том, что в связи со схожестью их химического строения с истинным гормоном, аналоги связываются с рецепторами гипоталамуса, но при этом не стимулируют, а наоборот снижают секрецию ЛГ. Это в конечном итоге приводит к снижению уровня тестостерона в крови. В отличие от хирургической кастрации, эффект медикаментозной кастрации обратим после отмены препаратов. К препаратам группы аналогов ЛГРГ относятся леупролид, гозерелин, трипторелин и др. Препараты могут использоваться в виде подкожных инъекций или имплантов. В зависимости от вида препарата, частота его введения может варьировать от одного месяца до года. Первый прием аналога ЛГРГ сопровождается кратковременным подъемом уровня тестостерона, после чего происходит его снижение до минимальной концентрации в крови. Первая инъекция у пациентов с распространенным раком сопровождается обострением опухолевого процесса и ухудшением симптомов заболевания. Такой феномен носит название вспышки. Он проявляется выраженными костными болями, компрессией спинного мозга, нарушением свертывания крови и др. Для предотвращения феномена вспышки на две недели назначаются антиандрогенные препараты.

Несмотря на то, что яички – основное место выработки тестостерона, небольшая его часть (10%) образуется в надпочечниках. Поэтому не всегда блокировка выработки андрогенов в яичках полностью снижает их концентрацию в крови, это значит, что надо блокировать и андрогены, образовавшиеся в надпочечниках. Иногда некоторые врачи использует антиандрогены как монотерапию рака простаты вместо орхэктомии или лечения агонистами ЛГРГ. Согласно результатам ряда исследований не выявлено разницы в выживаемости между пациентами, у которых гормональная терапия рака простаты проводилась агонистами ЛГРГ и антиандрогенами, хотя несколько работ свидетельствуют о более низкой эффективности антиандрогенов.
Чаще всего антиандрогены используются в комбинации с орхэктомией или агонистами ЛГРГ. Такое лечение называется комбинированной андрогенной блокадой.
К группе антиандрогенов относятся следующие лекарственные средства: ципротерона ацетат, флутамид, бикалутамид.
Во многих странах, применение ципротерона ацетата ограничено в связи с его выраженными побочными эффектами, в особенности тяжелыми поражениями печени после длительного приема препарата. Однако в ряде случаев лечение ципротероном оправдано, несмотря на побочные эффекты. Многие мужчины жалуются на диарею, ассоциированную с приемом флутамида. Флутамид и высокие дозы бикалуамида реже вызывают эректильную дисфункцию и другие побочные эффекты, по сравнению агонистами ЛГРГ. Но эти препараты чаще приводят к набуханию грудных желез и слабости.
Блокаторы рилизинг-гормона лютеинизирующего гормона (ЛГРГ) – они блокируют выработку ЛГ гипофизом, что в свою очередь останавливает синтез тестостерона. Эффект препаратов аналогичен действию агонистов ЛГРГ, но в отличие от агонистов, антагонисты приводят к более быстрому снижению уровня тестостерона в крови и не вызывают феномена вспышки. В настоящее время существует один препарат этой группы – дегареликс. Препарат вводится подкожно раз в месяц. Наиболее частые побочные эффекты: боль, покраснение и припухание в месте инъекции, повышение уровня ферментов печени.
Применение эстрогенов – женских гормонов – является альтернативой орхэктомии у мужчин с распространенным раком простаты. Многонаправленное действие эстрогенов (подавление секреции ЛГРГ, дезактивация андрогенов и др.) приводит к снижению уровня тестостерона в крови. Однако в связи тяжелыми побочными эффектами эстрогенов, а именно формированием тромбов и осложнениями со стороны сердечно-сосудистой системы, они были вытеснены аналогами ЛГРГ и анти-андрогенами. Тем не менее, эстрогены применяются в случае неэффективности андрогенной блокады.
К этой группе препаратов относится лишь одно лекарственное средство – абиратерон. Абиратерон был одобрен в апреле 2011 года для лечения мужчин с метастатическим раком простаты, резистентным к другим типам гормональной терапии или химиотерапии доцитакселом. Путем подавления активности фермента, участвующего в синтезе тестостерона, абиратерон подавляет выработку тестостерона и снижает его концентрацию в крови. При этом препарат подавляет синтез тестостерона и в яичках, и в надпочечниках, и в раковых клетках.
Побочные эффекты гормональной терапии
Увеличение и боль грудных желез, известные также как и гинекомастия, проявляются следующими симптомами: повышенная чувствительность и болезненность сосков, увеличение объема груди. Гинекомастия наблюдается при приеме антиандрогенов и эстрогенов.
Осложнения со стороны сердечно-сосудистой системы наблюдаются при длительном приеме эстрогенных препаратов. Образование тромбов, сердечные приступы – серьезные осложнения эстрогенной терапии. Прием противосвертывающих препаратов значительно снижает риск осложнений.
Изменение уровня холестерина в крови. Использование антиандрогенов повышает уровень холестерина и триглицеридов в крови.
Диарея и/или запор – побочный эффект гормональной терапии рака простаты, ассоциированный с приемом антиандрогенов.
Эректильная дисфункция/снижение либидо. Прием антиандрогенов и агонистов ЛГРГ вызывает эректильную дисфункцию, а агонисты еще и снижают либидо.
Усталость и утомляемость сопутствуют терапии антиандрогенами, агонистами ЛГРГ и эстрогенами.
Изменения скорости роста волос. Мужчины могут заметить, что на голове увеличилось количество волос, в то время как на остальных участках тела наблюдается потеря волос. Эти эффекты характерны для антиандрогенов и агонистов ЛГРГ.
Приливы (ощущения жара) наблюдаются при снижении уровня тестостеронов в крови. Частота и выраженность приливов индивидуальна для каждого мужчины.
Остеопороз. Применение любого из гормональных препаратов снижает уровень тестостеронов в крови и приводит к развитию остеопороза. Выраженность разрушения костей зависит от ряда факторов, таких как общее состояние здоровья до начала лечения, длительность гормонотерапии и др.
Уменьшение в размере пениса и мошонки. Снижение уровня тестостеронов в крови может иметь потенциальный риск уменьшения в размере мошонки и пениса.
Прибавка в весе и отложение жира в области живота. Антиандрогены и агонисты ЛГРГ предрасполагают к развитию ожирения.
Гормональное лечение рака предстательной железы
Рак простаты – один из самых актуальных вопросов современной онкомедицины. Ключевая проблема заключается в том, что по уровню летальности злокачественные образования, формирующиеся на предстательной железе, занимают 2-3 место среди прочих видов онкологии. План лечения рака предстательной железы определяет исключительно профильный специалист. Часто обращаются к гормональной разновидности медикаментозной терапии. Подробнее о нюансах и особенностях гормонального лечения рака предстательной железы узнайте из этой статьи.
Причины появления опухолей
Однозначного ответа о том, каковы причины, по которым формируется рак предстательной железы, до сих пор не существует. Можно выделить массу провоцирующих факторов, которые статистически имеют место в жизни мужчин, страдающих от онкологии с такой локализацией. В этот перечень входит:
- возраст более 60-65 лет;
- генетическая предрасположенность (особые отклонения в структуре ДНК);
- случаи заболевания по мужской линии семьи (считается, что в этом случае риск образования рака простаты в 10 раз выше);
- случаи образования злокачественных опухолей молочной железы по женской линии;
- нарушенный режим питания, несоблюдение диеты, преобладание в рационе животных жиров;
- приём тестостерона в лечебных целях (зачастую ошибочное назначение, ведущее к поражению простаты);
- дефицит витаминов и микроэлементов в организме;
- проведение вазэктомии (перевязка или усечение семявыносящего канала);
- вредные привычки.
Внимание! Рекомендуется не только отказаться от животных жиров, но и насытить свой ежедневный рацион соей, фитоэстрогенами, изофлавоноидами, токоферолом, селеном и каротиноидами.
Показания к гормональному лечению
Не всегда гормональная терапия рака простаты является действенным методом. Дать корректное назначение может только лечащий врач, имеющий полное представление о клинической картине ведомого пациента. Востребована гормонотерапия среди мужчин, чей возраст превышает 67-70 лет. Также прибегают к гормональному типу лечения на следующих стадиях развития образования:
- на 1-й стадия;
- при невозможности хирургического лечения;
- в случае серьезных противопоказаний к использованию химической терапии;
- при вторичном образовании раковых очагов, рецидиве поражения;
- при нежелании пациента проводить простатэктомию или пользоваться лучевой терапией, если образование не метастазировало за пределы простаты;
- на 3-4 стадии, когда опухоль находится не только в железе и за её пределами, но и метастазировала в другие органы;
- после хирургического вмешательства в целях замедления развития раковых очаговых, возникших из-за попадания клеток злокачественного образования на близлежащие органы;
- при повышенном уровне ПСА (простатический специфический антиген) – более 25 нг/мл;
- в сочетании с лучевой терапией или после её проведения для достижения оптимального эффекта;
- перед и после проведения простатэктомии;
- при необходимости контроля за развитием поражения простаты.
Статистически наибольшая эффективность у лечения рака простаты при помощи радикальной простатэктомии с полным иссечением предстательной железы. Однако оперативные процедуры не всегда возможны, как и альтернативная им терапия (химическая, лучевая). Фактически гормонотерапией пользуются как методом, который, если и не помогает излечить рак простаты, то хотя бы продлевает жизнь пациенту.
Разновидности гормонотерапии
Ранее лечение рака простаты посредством гормонального контроля заключалось в проведении двусторонней орхиэктомии (удаление яичек) – это позволяло снизить уровень тестостерона в организме (считается, что именно переизбыток этого гормона в организме является одной из причин рака предстательной железы). Современная онкомедицина исключает необходимость операции, т.к. можно использовать специальные медикаменты, понижающие уровень тестостерона до необходимого в целях лечения.
В здоровом мужском организме содержание тестостерона составляет от 300 до 1000 нг/дл. Медикаментозно этот уровень может быть понижен до 50 нг/дл, но зачастую медики стремятся к минимально возможному уровню гормона – 20-30 нг/дл. Рассмотрим подробнее, какие виды гормональных препаратов используются при лечении поражения простаты.
Агонисты ЛГРГ
Освобождающий лютеинизирующий гормон (ЛГРГ) – это пептидный гормон, направляющий химическую реакцию к мозговым клеткам, вызывая продукцию тестостерона. Агонисты данного гормона отвечают за блокировку его функций, соответственно предотвращая выработку тестостерона половой системой.
Данные медикаментозный вариант лечения является одним из самых распространенных и востребованных при борьбе с раком предстательной железы. Выпускается необходимый препарат не в таблеточном, а в жидком ампульном виде для введения через мышечные или жировые ткани, поскольку пептиды растворяются в ЖКТ, не достигая цели.
Введение препарата осуществляется раз в месяц, либо для его автоматической подачи в организм используется специальный имплантат, вводимый под кожу. В этом случае вещество поступает в организм медленно, а установленный элемент заменяется раз в полгода или год.
Стоит отметить, что в первые 3-4 недели после первичного введения агонистов ЛГРГ уровень тестостерона возрастает, вызывая обострение симптоматики рака предстательной железы. При сильном болевом синдроме или выявлении активного роста опухоли за пределы простаты врач может назначить вспомогательный курс антиандрогенов. Со временем дискомфорт и плохое самочувствие уйдут, а уровень тестостерона начнет снижаться, что и требуется для эффективного лечения.
Побочные эффекты от гормонотерапии с использованием агонистов ЛГРГ:
- пониженное сексуальное влечение;
- гинекомастия (рост молочных желез);
- болевой синдром в грудном отделе;
- снижения мышечной массы на фоне увеличения веса;
- ощущение усталости и общей слабости в теле;
- снижение уровня «хорошего» холестерина.
Крайне популярно при терапии рака с помощью агонистов ЛГРГ использовать схему дискретного дозирования. Суть такого лечения заключается в периодической приостановке введения препаратов и последующем возобновлении. Статистика показывает, что выраженность побочных эффектов при таком подходе уменьшается. Однако преимущества и эффективность такой терапии не изучены до конца.
Антагонисты ЛГРГ
В сравнении с агонистами данный вид препаратов используется крайне редко. На данный момент является изученной и производимой лишь одна форма такого медикамента для гормонотерапии – дегареликс (отечественный вариант – «Фирмагон»). В онкомедицине к нему обращаются преимущественно на 3-4 стадии развития рака предстательной железы с метастазированием в костную ткань. Медикамент позволяет предотвратить компрессию спинного мозга, вызываемую сдавливанием опухолью.
Антагонист ЛГРГ не повышает уровень тестостерона, а симптоматика, которой сопровождается рак простаты, блокируется. Первичная доза составляет 2 шприца по 120 мг, а потом 80 мг через 1 месяц. В дальнейшем процедура повторяется раз в месяц.
Зачастую побочные эффекты такой гормонотерапии:
- анемия;
- понос;
- тошнота;
- рвота;
- головная боль;
- бессонница;
- кожные покраснения и боль в месте укола.
Случаев передозировки препаратом не выявлено.
Антиандрогены
Это препараты периферического действия, которые блокируют продукцию мужских гормонов надпочечниками. Стоит отметить, что действующие компоненты антиандрогенов вызывают минимум побочных эффектов в сравнении с другими препаратами, используемыми при лечении посредством гормонотерапии. Однако эффективность данных средств снижается, если рак предстательной железы начинает распространяться в ближайшие органы и ткани.
Первичный эффект от использования в сочетании с агонистами ЛГРГ – это сильнейшее увеличение уровня тестостерона в организме, что приводит к росту предстательной железы в размерах и усложнению мочеиспускательного процесса. Если рак простаты метастазировал в костную ткань, то использование антиандрогенов усиливает болевой синдром в костях, повышает риск получения травмы, перелома или ущемления нервных окончаний.
Если же проводить гормонотерапию попеременно, сначала используя антиандрогенные медикаменты, а затем переходя на агонисты ЛГРГ, то количество побочных эффектов уменьшится. Как показывает практика, если от использования антиандрогенов нет эффекта, то временное прекращение лечения способствует улучшению самочувствия пациента. Медицинская терминология определяет для такого состояния название «андрогенное отторжение».
Эстрогены
Синтетически выведенный гормон эстроген (он является сугубо женским) может быть использован в гормонотерапии при лечении у мужчин рака предстательной железы. Снижение уровня тестостерона в этом случае происходит за счет принудительного выделения лютеинизирующего вещества гипоталамусом. Даже при допустимой дозировке в 3-5 мг эстрогеносодержащие препараты провоцируют образование хронических патологий сердечно-сосудистой системы, а также увеличивают риск сердечного приступа.
В качестве защитной меры для организма пациента в процессе лечения медики снижают дозировку до суточного приёма в 1 мг. Но при этом уже через 6-12 месяцев тестостерон вновь начинает накапливаться в организме, что сводит борьбу с раком предстательной железы на нет, если положительный эффект от проводимого лечения не был достигнут ранее.
Орхиэктомия
Если всё же врач прибегает к использованию орхиэктомии, то проводится оперативное вмешательство с иссечением яичек. На их место для сохранения эстетичности в мошонку могут быть помещены искусственные заменители (имплантаты). Подобная операция эффективно уменьшает уровень тестостерона в организме. Вся процедура занимает около 1,5 часа и небольшого реабилитационного периода вплоть до снятия швов со сделанных ранее надрезов. При всей радикальности операции у неё те же побочные эффекты, что и агонистов ЛГРГ.
Однако, как уже было сказано ранее, оперативное вмешательство – это не безальтернативный вариант. Современные медикаментозные подходы к лечению поражения предстательной железы достаточно эффективны. От них отказываются в случае нехватки финансов или продолжительного отсутствия положительных результатов. Также орхиэктомия назначается пожилым пациентам, которые не могут посещать медкабинет с целью проведения гормональной терапии (введения препаратов по графику).
Сочетанная блокировка андрогенов
Гормональная терапия при раке, проводимая по этому принципу, заключается в одновременном приёме медикаментов, воздействующих на мозговую активность и периферически на функционал надпочечников. Тестостерон не только перестаёт вырабатываться, но и прекращает действовать непосредственно в простате. Однако количество побочных эффектов от такого метода лечения превышает его положительные качества. Выраженными проявлениями зачастую являются: отсутствие сексуального желания, импотенция, понос, тошнота, дисфункция печени.
Общие побочные эффекты гормональной терапии
Помимо того, что у конкретных методов имеются собственные недостатки, стоит указать на те проявления, которые могут формироваться при приёме любых медикаментов. К ним относятся:
- чувство повышенной температуры тела, сменяющееся ощущением озноба;
- различный уровень снижения сексуального желания и нарушения потенции вплоть до полной её потери;
- развитие сахарного диабета;
- нарушение работы ЖКТ;
- дестабилизация памяти;
- слабость и вялость;
- ожирение;
- риск формирования тромбофлебита;
- остеопороз с возможными беспричинными механическими повреждениями вплоть до переломов;
- нарушенные обмен веществ и метаболизм, ведущие к наращиванию объемов жировой ткани и уменьшению мышечной массы;
- негативное воздействие на сердечно-сосудистую систему с появлением риска приступов и скачками давления.
Однако столь широкий перечень побочных эффектов проявляется в полном объеме крайне редко. Грамотно спланированный процесс лечения, построенный на использовании оптимальных медикаментозных средств, имеет предельно высокую эффективность и даёт положительные результаты в борьбе со злокачественной опухолью. Однако полного выздоровления посредством терапии добиться крайне сложно, если быть точнее, то она должна применяться в комплексе с другими современными методами лечения.
Зачастую гормональную терапию используют для замедления интенсивности развития онкологического образования. Она необходима для контроля над онкологической патологией и сохранения привычного режима жизнедеятельности пациента. С помощью терапии можно повышать эффективность других методов, либо просто продлевать срок жизни для мужчины, чей клинический случай является бесперспективным в ракурсе полного выздоровления.
Прогноз и оценка эффективности метода
Когда онкологическое поражение только диагностируется, прогноз может быть рассчитан исходя из результатов дифференцирования выявленного новообразования (злокачественное или доброкачественное) и определения стадии его развития. Для мужчин с опухолью М1 (1-2 стадия) уровень выживаемости составляет от 28 до 53 месяцев. Для малой доли пациентов (7%), прошедших курс терапии при раке простаты, он составляет более 10 лет.
Важно! «Уровень выживаемости» – это не термин, который становится приговором. Это срок, который прошел с момента прохождения лечебного курса конкретным пациентом. По истечению данного срока он был снят с учета, потому в историю болезни записывается обозримый период жизни.
Прогнозировать перспективы развития опухоли и лечебного воздействия на неё можно, основываясь на следующие показатели:
- постоянно контролируемый уровень ПСА;
- баллы по шкале Глисона;
- интенсивность метастазирования в другие органы и ткани;
- наличие симптоматики, связанной с поражением костной ткани.
В случае местно-распространенного развития рака выживаемость составляет более 10 лет.
Именно уровень ПСА является контрольным значением. Нормальным уровнем его понижения спустя 1,5-2 месяца после того, как было начато гормональное лечение рака предстательной железы, является значение в 1/10 нг/мл. Однако и при уровне в 5/10 нг/мл можно рассчитывать на благоприятный прогноз. Помимо контроля за уровнем ПСА многое зависит от агрессивности злокачественного образования и схематики воздействия метастазов на организм пациента.
Профилактические меры
Завершение лечебного курса – это не последняя стадия борьбы с заболеванием. В случае со злокачественными опухолями необходимо предотвращать возможный рецидив, контролируя каждый свой шаг вне стен медицинского учреждения. К набору профилактических мероприятий, которые назначаются мужчинам, прошедшим один из вышеперечисленных лечебных курсов, относятся:
- Сбалансированная диета. Ранее говорилось о необходимости снижения объемов употребления жирной пищи. Также рекомендуется максимально отказаться от соли и различных специй.
- Витамины и минералы. Ежедневное меню пациента должно пополниться овощами, фруктами, молочной продукцией. Следует прибегнуть к дроблению пищи и употреблению её мелкими порциями, но при этом увеличить количество приёмов в течение дня. Потеря или снижение аппетита не должны становиться причиной отказа от питания. Установленный режим необходимо соблюдать на постоянной основе.
- Для предотвращения образования остеопороза медики назначают витаминсодержащие продукты и препараты – пациенту крайне необходимы кальций и витамин D. Многие специалисты самостоятельно разрабатывают оптимальный рацион, дополняя его набором медикаментов профилактической направленности.
- Отказ от вредных привычек. Курение и употребление алкоголя должны стать табу для пациента и, желательно, его ближайшего круга общения.
- Также необходимо исключить употребление кофеиносодержащих напитков.
- Должен быть установлен четкий режим дня с регулярным отдыхом и прогулками на свежем воздухе, а также почасовым приёмом пищи.
- Любые физические упражнения должны проводиться без перенапряжения и только после реабилитационного периода, если борьба с раковым образованием осуществлялась посредством хирургического вмешательства.
- Во время прогулок желательно передвигаться пешком, постоянно увеличивая преодолеваемое в течение дня расстояние.
- Ежедневно необходимо выпить 2 литра жидкости.
Мужчина также должен быть ограждён от стресса и нервного перенапряжения. Осторожность в целях предотвращения механических повреждений также должна стать ключевым принципом жизнедеятельности.
Обращение в Центр эндоваскулярной хирургии
Медицинский центр профессора Капранова – это профильное учреждение, где помощь может получить любой онкобольной. Обращение к нашим специалистам гарантирует вам качественную диагностику с точным дифференцированием и определением стадии развития опухоли. Врачи центра находят индивидуальный подход к каждому пациенту, формируя оптимальный план лечебных курсов. При этом хирургическое вмешательство не назначается никогда, если существует возможность альтернативного подхода к борьбе с раковым образованием.
Изучите внимательно наш сайт, ознакомившись с ключевыми особенностями работы центра. Прочитайте и другие статьи, чтобы узнать о методах онкомедицины. Имейте представление о наших возможностях. Многое о нас можно узнать из отзывов других пациентов, прошедших лечебные курсы у медиков центра. Можно оставить собственный комментарий, если у вас уже сложилось впечатление о нас.
Ответственность и профессионализм – это лишь малая часть достоинств наших врачей и медперсонала. Всем обратившимся гарантируются выгодные условия и комфорт пребывания в центре. Будьте здоровы, а мы вам в этом поможем, исходя из особенностей и потребностей каждого пациента!
Основные направления деятельности центра эндоваскулярной хирургии а также другие популярные материалы:
Эмболизация маточных артерий в гинекологии
ЭМА в Москве
Эмболизация сосудов аденомы простаты
Автор: Капранов С.А
Доктор медицинских наук, профессор, дважды Лауреат Государственных Премий Правительства Российской Федерации в области науки и техники, Лауреат Премии Ленинского Комсомола, автор более 350 научных работ по медицине, 7 монографий, и 10 патентов на изобретения по медицине
Лечение рака простаты гормональным методом
Рак предстательной железы (РПЖ) в настоящее время является одним из наиболее распространенных видов злокачественных новообразований в мире. По заболеваемости РПЖ занимает 1 место в США и 2 место (после рака легкого) в странах Западной Европы. В России в 2002 году опухоли предстательной железы заняли 4 место в структуре онкологической заболеваемости мужского населения после рака легкого, желудка и новообразований кожи. При этом по темпу роста показателя заболеваемости РПЖ значительно опережает опухоли других локализаций. Развитие ситуации в последнее десятилетие в России очень похоже на положение, сложившееся в США во второй половине 80-х и начале 90-х годов. Связано это с широким распространением в клинической практике теста по определению уровня простатического специфического антигена (ПСА) в сыворотке крови и мультифокальной трансректальной биопсии предстательной железы. Диагностика РПЖ на основе определения ПСА привела не только к увеличению выявляемости больных, но и изменила структуру распределения больных по стадиям опухолевого процесса в сторону преобладания более ранних стадий заболевания. Так, в 2002 году в России доля больных, у которых выявлена I-II стадия заболевания, составила 33,8%, а III стадия – 38,5%. У 23,3 % пациентов первично диагностируется метастатический РПЖ.
Одним из основных видов лечения РПЖ является гормональная терапия. На стадии генерализованного (метастатического) опухолевого процесса гормонотерапия является ведущим и наиболее эффективным вариантом лечения, позволяющим добиваться ремиссии и стабилизации заболевания у большинства больных. При локализованном (II стадия) и местно-распространенном (III стадия) РПЖ гормональная терапия также может применяться как самостоятельный метод лечения, но более распространенным вариантом лечебной тактики является применение эндокринных воздействий в сочетании с хирургической операцией или лучевой терапией.
Гормонотерапия может проводиться перед началом хирургического или лучевого лечения, в этом случае ее принято называть неоадъювантной. В том случае, когда гормональное лечение назначается после операции или облучения, терапия обозначается как адъювантная. В настоящее время в клинической практике используется несколько различных режимов и схем комбинированного лечения РПЖ с применением гормональной терапии. Основной целью проведения неоадъювантной и адъювантной гормонотерапии является увеличение общей и безрецидивной выживаемости больных РПЖ, но в различных клинических ситуациях гормонотерапия решает различные задачи.
Неоадъювантная гормонотерапия перед хирургическим лечением РПЖ
Наиболее радикальным методом лечения больных с интракапсулярным РПЖ (T1-T2N0M0) и некоторых больных с экстракапсулярной инвазией опухоли (T3aN0M0) является радикальная простатэктомия (РПЭ). Хирургическое лечение не приводит к большому числу осложнений и обеспечивает высокие показатели общей и опухолево-специфичной выживаемости больных. Однако трудности предоперационной оценки степени распространенности опухоли предстательной железы и соответственно клинической стадии РПЖ приводят к гиподиагностике распространенности процесса на дооперационном этапе и к снижению в связи с этим хирургического радикализма.
По данным клиники Mэйо, располагающей опытом нескольких тысяч РПЭ, почти у половины больных с клинически локализованным РПЖ при послеоперационном морфологическом исследовании выявили инвазивный рост в парапростатическую клетчатку, прорастание в семенные пузырьки или метастазы в тазовых лимфатических узлах. Увеличению числа нерадикальных операций способствует также стремление хирурга к достижению хороших функциональных результатов и применение в связи с этим нервосберегающей (для сохранения потенции) и уретросберегающей (для улучшения функции произвольного мочеиспускания) техники при недооценке возможности экстракапсулярного распространения опухоли. Так, по данным различных хирургов, количество операций, сопровождающихся наличием опухоли по линии резекции, составляет 0-71% (в среднем 28%).
При анализе операционного патоморфологического материала после 1,088 РПЭ, выполненных в клинике Mэйо у больных с клинической стадией Т3 (выход опухоли за пределы капсулы предстательной железы), наличие опухолевого роста по линии резекции выявлено у 537 (49%) больных, а у 326 (30%) больных обнаружены метастазы в регионарных лимфатических узлах. Метод неоадъювантной (предоперационной) гормональной терапии был предложен с целью повышения радикализма оперативного вмешательства, уменьшения числа рецидивов и соответственно с целью улучшения безрецидивной выживаемости. Еще в 1944 г. Vallet предложил выполнять перед промежностной РПЭ двустороннюю орхидэктомию. В последующем были опубликованы данные об увеличении 10- и 15-летней выживаемости больных местно-распространенным РПЖ, которым перед РПЭ выполнялась хирургическая кастрация. Выраженное уменьшение размеров опухоли и торможение опухолевого роста за счет апоптоза (программируемой гибели) злокачественных клеток в результате неоадъювантной гормонотерапии продемонстрировано в ряде экспериментальных работ на перевивных опухолях у мышей.
Но билатеральная орхидэктомия и эстрогенотерапия не нашли широкого применения в клинике в качестве вариантов неоадъювантной гормонотерапии вследствие значительного числа побочных эффектов. Наиболее интенсивно метод предоперационной гормонотерапии стал развиваться после того, как в клинической практике использовать агонисты ЛГРГ (Золадекс, леупролид) и нестероидные антиандрогены (Касодекс, Флутамид), которые применялись, в основном, в режиме комбинированной (максимальной) андрогенной блокады.
В исследовании канадской группы Labrie (1993) применение комбинированной блокады андрогенов в течение 3 месяцев привело к снижению частоты выявления опухолевого роста по линии резекции до 13% по сравнению с 38% в группе больных, которым проводилось только хирургическое лечение. Максимальная андрогенная блокада использовалась в качестве неоадъювантной гормонотерапии и в других исследованиях, также показавших достоверное снижение частоты нерадикальных операций у больных, получавших неоадъювантную гормонотерапию (табл. 1).
Таблица 1. Частота выявления опухоли по линии резекции (%) в исследованиях по неоадъювантной гормонотерапии
Несмотря на повышение радикализма оперативных вмешательств, которое обеспечивает неоадъювантная гормонотерапия, ни в одном исследовании не было достигнуто различий в частоте и длительности безрецидивного периода после РПЭ. Развитие биохимического рецидива РПЖ (повышение уровня ПСА>0,1) наблюдалось одинаково часто как у больных, которым проводилась неоадъювантная гормонотерапия, так и у больных, получивших только хирургическое лечение. Однако ни в одной публикации, посвященной неоадъювантной гормонотерапии перед РПЭ, не приводятся отдаленные результаты лечения (общая и опухолево-специфическая выживаемость больных в течение 5 и 10 лет).
Для того чтобы повысить эффективность предоперационной гормонотерапии предлагается несколько способов, основным из которых является увеличение длительности курса гормонального лечения. Предлагается вместо традиционного 3-месячного курса проводить андрогенную блокаду в течение 8 и 12 мес. Ряд авторов считает целесообразным проводить гормональную терапию до максимального снижения уровня ПСА. Однако следует помнить, что удлинение предоперационного периода всегда таит опасность прогрессирования опухолевого процесса, несмотря на гормональные воздействия.
Другим возможным вариантом улучшения результатов комбинированного лечения является применение новых схем гормональной терапии, в частности, монотерапии антиандрогенами. В настоящее время в отделении онкоурологии МНИОИ им. П. А. Герцена, а также в клиниках урологии Военно-медицинской академии и Российской медицинской академии последипломного образования проводится изучение эффективности предоперационной гормонотерапии касодексом в дозе 150 мг в течение 3 месяцев у больных с высоким риском распространения опухоли за пределы капсулы предстательной железы. Предварительные результаты показывают, что терапия касодексом в дозе 150 мг приводит к снижению уровня ПСА на 86,1% и уменьшению объема предстательной железы на 44%. Частота биохимического прогрессирования в течение 6-18 мес после РПЭ составляет 33,3% в группе больных, получавших касодекс и 54,6% в группе хирургического лечения.
Адъювантная гормональная терапия после хирургического лечения РПЖ
Несмотря на то, что у большинства больных с клинически локализованным (интракапсулярным) РПЖ в результате хирургической операции достигается полное излечение от болезни, у 30% пациентов после РПЭ развивается рецидив заболевания. Первоначально, как правило, у этих больных развивается биохимический рецидив – (рост уровня ПСА в сыворотке) без признаков местного рецидива или генерализации. На этой стадии в организме больного существуют микроскопические группы клеток РПЖ, которые не могут быть выявлены существующими методами диагностики.
Развитие ПСА-прогрессирования может отражать как местный рецидив болезни, так и диссеминацию опухолевых клеток по лимфатическим путям и внутренним органам. Проведение адъювантного гормонального лечения наиболее целесообразно на этой стадии заболевания, так как эффективность терапии более высока при небольшой опухолевой массе. Кроме того, при минимальных проявлениях болезни общее состояние больного остается хорошим, что позволяет назначать адекватные дозы и режимы лечения.
Адъювантная гормональная терапия после РПЭ назначается, в основном, при выявлении инвазии опухоли за пределы капсулы предстательной железы, опухолевого роста по линии резекции или метастазов в тазовых лимфатических узлах. К настоящему времени проведено несколько крупных исследований, которые показали преимущество немедленной адъювантной гормонотерапии перед наблюдением после РПЭ. У пациентов, получавших немедленную гормонотерапию, значительно реже развивались такие осложнения РПЖ как боли в метастатических очагах, инфравезикальная обструкция, требующая выполнения трансуретральной резекции предстательной железы, патологические переломы, компрессия спинного мозга.
В специальном исследовании, посвященном применению послеоперационной гормонотерапии у больных без метастазов в лимфатических узлах, безрецидивная выживаемость в течение 5 лет регистрировалась на 25,2% чаще. Наиболее часто адъювантную гормонотерапию назначают больным, у которых выявляют метастатическое поражение тазовых лимфатических узлов. В исследовании ECOG продемонстрировано статистически достоверное увеличение общей выживаемости при проведении адъювантного лечения после РПЭ при выявлении метастазов в лимфатических узлах.Рецидивы РПЖ в течение 7 лет после операции диагностированы только у 14,9% больных, получавших немедленную послеоперационную гормонотерапию и у 89,4% больных, которым адъювантное лечение не проводилось.
В рамках программы ЕРС (ранний рак предстательной железы) было проведено большое исследование, посвященное оценке эффективности адъювантной гормонотерапии (включало 8,013 больных). Больным после местного лечения (РПЭ, лучевая терапия или наблюдение) назначали гормонотерапию касодексом в дозе 150 мг, контрольная группа получала плацебо.
После наблюдения в течение 3 лет выявлено достоверное снижение риска прогрессирования РПЖ (на 42%) и риска развития костных метастазов (на 33%) в группе пациентов, получавших касодекс. Также отмечено, что снижение риска прогрессирования болезни при назначении касодекса 150 мг особенно выражено в подгруппе больных с лимфогенными метастазами.
Неоадъювантная гормонотерапия перед лучевой терапией РПЖ
Дистанционная лучевая терапия по радикальной программе и внутритканевая лучевая терапия (брахитерапия) наряду с хирургическим лечением являются основными методами лечения локализованного и местно-распространенного РПЖ. Эффективность лучевой терапии в большой степени зависит от дозы облучения, которая подводится к предстательной железе. Многочисленные исследования показали, что лучшие результаты лечения достигаются при дозе облучения 70 Гр и более.
Однако увеличение дозы лучевой терапии приводит к увеличению частоты и выраженности побочных токсических эффектов со стороны окружающих органов, в первую очередь, мочевого пузыря и прямой кишки. Проведение неоадъювантной гормонотерапии перед дистанционным облучением позволяет уменьшить объем предстательной железы и соответственно уменьшить объем окружающих тканей, попадающих в зону облучения. Так, после 3 месяцев неоадъювантной терапии золадексом объем предстательной железы уменьшается на 37%, а лучевая нагрузка на мочевой пузырь и прямую кишку снижается, соответственно на 46 и 18%.За счет меньшей лучевой нагрузки на окружающие ткани после неоадъювантной гормонотерапии возможно подведение к предстательной железе более высокой дозы облучения, что приводит к повышению эффективности лучевого лечения. В большом рандомизированном исследовании было показано, что местный рецидив в течение 8 лет после лучевой терапии локализованных и местно-распространенных форм РПЖ развился у 37% больных, получавших неоадъювантную гормональную терапию по схеме максимальной андрогенной блокады (золадекс и флутамид), и у 49% больных, которым неоадъювантная гормонотерапия не проводилась. Выживаемость больных в группе комбинированного лечения также оказалась более высокой, но различия не были статистически достоверными.
В другом исследовании больным РПЖ через 2 года после окончания дистанционной лучевой терапии выполняли биопсию предстательной железы. Остаточная опухоль в биопсийном материале выявлена у 29% больных, которым проводили неоадъювантную терапию по схеме максимальной андрогенной блокады в течение 3 месяцев перед облучением, и у 69% больных, которые гормональное лечение не получали. Нередко неоадъювантную гормонотерапию с целью уменьшения объема предстательной железы назначают перед проведением брахитерапии, так как выполнение эффективной имплантации радиоактивных зерен возможно при объеме простаты, не превышающем 50-60 куб. см.
Адъювантная гормональная терапия после лучевой терапии РПЖ
Проведение гормональной терапии во время и после окончания курса лучевой терапии также позволяет улучшить результаты лечения больных РПЖ. В большом исследовании, включающем 977 больных, сравнивали эффективность самостоятельной дистанционной лучевой терапии РПЖ и облучения с последующей адъювантной терапией золадексом в течение всей жизни пациента. Адъювантная гормонотерапия привела к увеличению безрецидивной выживаемости до 60% по сравнению с 44% в группе только лучевого лечения и уменьшению частоты развития биохимического рецидива РПЖ с 53% до 20% (при среднем периоде наблюдения 4,5 года).
Наиболее эффективна оказалась адъювантная гормонотерапия в подгруппе больных с плохими прогностическими факторами: выраженным распространением опухоли за пределы капсулы и на окружающие органы и низкой степенью гистологической дифференцировки РПЖ.
В другом исследовании, проведенном Европейской группой по изучению рака, терапию золадексом проводили в течение 3 лет после дистанционной лучевой терапии местно-распространного РПЖ. Общая 5-летняя выживаемость больных, получавших адъювантную гормональную терапию, достоверно превышала выживаемость в группе больных, которым проводили только облучение, а гормонотерапию назначали при рецидиве заболевания (соответственно 79 и 62%). Кроме того, показатель безрецидивной выживаемости также оказался значительно выше в группе адъювантного лечения (85%) по сравнению с группой лучевой терапии (48%). Средняя длительность безрецидивного течения составила 6,6 лет в группе комбинированного лечения и 4,4 года в группе больных, не получавших адъювантного гормонального лечения.Следует отметить, что оптимальная длительность адъювантной гормонотерапии после лучевой терапии в настоящее время не определена, но продолжительность курса гормонального лечения менее 6 месяцев не приводит к улучшению результатов лечения.В последние годы в клинической практике стали использоваться режимы интермиттирующей (прерывистой) гормональной терапии. В некоторых исследованиях показана одинаковая эффективность адъювантной интермиттирующей и непрерывной гормонотерапии после лучевого или хирургического лечения РПЖ, но число больных и сроки наблюдения невелики, поэтому вопрос о возможности проведения прерывистой гормонотерапии с адъювантной целью нуждается в дальнейшем изучении.
Таким образом, неоадъювантная и адъювантная гормональная терапия с применением современных эффективных препаратов позволяет существенно улучшить результаты лечения больных РПЖ.
Автор: кандидат мед.наук Б.Я.Алексеев
Материал взят из журнала “Вместе против рака” , №3, 2004.
Материалы конгрессов и конференций
К распространенному раку предстательной железы принято относить местно-распространенную опухоль (Т3-4) или опухоль с метастазами, или сочетание первого и второго. В настоящее время основным методом лечения больных распространенным раком предстательной железы является гормонотерапия, которая включает два подхода: монотерапия (кастрация, эстрогенотерапия, антиандрогены) или комбинированное лечение, включающее сочетание кастрации (хирургической или медикаментозной) с антиандрогенами. Цель лечения – создание андрогенной блокады.
С тех пор, как Huggins и Hodges показали гормональную зависимость рака предстательной железы, прошло уже более 50 лет, однако гормонотерапия по-прежнему остается ведущим методом лечения распространенных форм этой опухоли. Необходимо, между тем, четко понимать, что речь идет о паллиативном лечении, эффект от которого временный. При наличии отдаленных метастазов прогрессирование заболевания возникает обычно в течение первых двух лет, а продолжительность жизни после появления признаков прогрессии, как правило, исчисляется месяцами.
Стандартные методы гормонотерапии рака предстательной железы хорошо известны клиницистам, многократно обсуждались. Поэтому мы хотим остановиться лишь на некоторых современных концепциях лечения этого заболевания, которые, на наш взгляд, представляются важными. Когда начинать лечение? Что может дать монотерапия антиандрогенами в высоких дозах? Насколько необходима максимальная андрогенная блокада (МАБ)? Каковы возможности интермиттирующей терапии?
Сразу после внедрения в клиническую практику гормонотерапии начались споры об оптимальном времени ее проведения. В настоящее время гормонотерапию при распространенном раке предстательной железы стараются назначать как можно раньше в надежде на более позднее появление болевого синдрома и увеличение продолжительности жизни. Однако правильность такого подхода некоторыми исследователями (Lepor H., et al.,1982) ставится под сомнение.
Некоторые авторы предлагают альтернативную тактику лечения, исходя из того, что проведение гормонотерапии можно отложить до появления признаков прогрессирования заболевания. В этом случае лечение может позволить добиться ремиссии, и продолжительность жизни больного будет не меньше, чем при немедленном начале лечения. На основании данных рандомизированных исследований Объединенной группы исследований в урологии The Veterans Administration Cooperative Urological Research Group (VACURG) Byar D.P. делает вывод о том, что “гормонотерапия при раке предстательной железы может быть отсрочена. “. В этих работах не было выявлено неблагоприятных последствий отсроченного лечения и было отмечено, что многие больные с распространенным раком предстательной железы (по данным VACURG- 41%) умирают от сопутствующих заболеваний. Таким образом, ряд исследователей считает, что отсроченная гормонотерапия при раке предстательной железы имеет преимущества перед начатой сразу после постановки диагноза (Kirk D.,1987).
Более поздние исследования (Рабочая группа по изучению рака предстательной железы Совета по исследованиям в медицине, Англия), предварительные результаты которых были опубликованы в 1997 году, позволили авторам сделать вывод о более высокой эффективности раннего, сразу после постановки диагноза, начала гормонотерапии. Однако данные для подгрупп больных, у которых на момент постановки диагноза отсутствовали отдаленные метастазы, еще не окончательны.
Большинство методов эндокринотерапии рака предстательной железы направлено на снижение уровня тестостерона в крови путем подавления его синтеза в яичках и коре надпочечников. Возможные варианты и методы андрогенной блокады представлены в таблице.
Идеальная терапия рака предстательной железы включает блокаду действия андрогенов на клеточном уровне предстательной железы, что реализуется снижением связывания дигидротестостерона с ядерным рецептором при конкурентном торможении или снижении концентрации цитоплазматического рецептора андрогенов.
Для блокады циркулирующих андрогенов используются как стероидные, так и нестероидные антиандрогены (андрокур, флуцином, анандрон, касодекс). Эти препараты нашли широкое применение в клинической практике, их эффективность хорошо изучена и прекрасно известна клиницистам.
Из современных концепций лечения распространенного рака предстательной железы заслуживает внимание монотерапия антиандрогенами. Результаты всех исследований, в которых оценивали эффективность монотерапии антиандрогенами, предоставили убедительные доказательства активности и в целом хорошей переносимости нестероидных антиандрогенов. Важным остается вопрос, можно ли добиться повышения эффективности лечения при повышении дозы, и какова эффективность монотерапии антиандрогенами в сравнении с таким стандартным методом, как кастрация. Целью ряда международных исследований стало установление эффективности больших доз касодекса (150 мг) в монотерапии. Значительный интерес представляют результаты, приведенные Iversen P. с соавт. (1998), проведших сравнительный анализ монотерапии касодексом и кастрации (хирургической или медикаментозной). В исследование были включены 1453 пациента с распространенным раком предстательной железы Т3-4М0 или доказанным М1. Анализ проводился после 4 лет наблюдения. В результате было показано, что для пациентов без метастазов действие касодекса эквивалентно кастрации и может являться альтернативой как хирургической, так и медикаментозной кастрации. У пациентов с отдаленными метастазами продолжительность жизни была на 42 дня больше в группе кастрации. Однако анализ качества жизни продемонстрировал значительное преимущество касодекса. Так, пациенты, получавшие 150 мг касодекса, сохраняли либидо и половую потенцию, а также физическую работоспособность на достоверно более высоком уровне, чем больные подвергнутые кастрации. Эти преимущества в качестве жизни чрезвычайно важны, учитывая паллиативный характер лечения. Таким образом, некоторое уменьшение времени выживания компенсируется значительным улучшением качества жизни. Аналогичные результаты представлены и в исследованиях Р. Schellhammer (1999), F.H. Schroder (1999), G.J. Kolvenbag, A. Nash (1999) и ряда других авторов. Однако на сегодняшний день еще нет достоверных данных о преимущественной эффективности данного вида лечения по сравнению со стандартными методами.
Билатеральная орхидэктомия (хирургическая кастрация) является эффективным методом снижения в крови основного биологически активного андрогена – тестостерона, но не оказывает действия на продукцию адренальных андрогенов. Препараты эстрогенного действия подавляют продукцию тестостерона яичками путем торможения секреции гонадотропинов и не действуют на секрецию адренальных андрогенов.
Использование аналогов ЛГРГ (LHRH) позволило добиться эффекта кастрации медикаментозным путем. Препараты этой группы (золадекс, лейопролид, декапептил, деферелин и др.) достаточно давно и прочно вошли в арсенал гормональных средств, применяемых для лечения распространенных форм рака предстательной железы.
В лечении диссеминированного рака предстательной железы в последние два десятилетия нашло широкое распространение использование комбинации кастрации (хирургической или медикаментозной) и антиандрогенов. Такая комбинация получила название максимальной андрогенной блокады (МАБ).
После публикации в 1982 г. работы Labrie F., сообщившего о фантастических преимуществах МАБ (94% частичных регрессий и 6% стабилизации), интерес к этой проблеме стал повсеместным и повлек за собой многочисленные клинические исследования. Итоги этих исследований неоднократно обсуждались в литературе. Однако до настоящего времени нет единого мнения о роли МАБ в лечении рака предстательной железы. Некоторые авторы показывали преимущества МАБ по сравнению с медикаментозной или хирургической кастрацией. С другой стороны, не было найдено преимуществ этого метода по сравнению с “золотым стандартом” лечения распространенного рака предстательной железы – кастрацией. В связи с этим были проведены ретроспективные анализы полученных в США и Европе результатов (Crawford et al 1989, Denis et al 1993, Janknegt et al 1993, Вertagna et al 1994).
Итоги многолетнего опыта применения МАБ подведены на двух международных консультациях по раку простаты (Монако,1996 и Париж,1999). Было отмечено, что в большинстве случаев применение МАБ по результатам сравнимо с кастрацией. Небольшое преимущество данный метод лечения имеет у больных с минимальным распространением болезни (единичные костные метастазы или поражение регионарных лимфатических узлов). Использование МАБ оказывает хорошее симптоматическое действие и способствует улучшению качества жизни больных, имеющих метастазы.
Однако, как при любом виде гормональной терапии, через какой-то промежуток времени МАБ теряет эффективность. В случае прогрессирования заболевания на фоне МАБ рекомендуется отменить лечение антиандрогенами, так как известен так называемый “синдром отмены антиандрогенов”. После отмены антиандрогенов у 10-15% больных наступает временная стабилизация заболевания. Немаловажным аспектом, особенно для России, является экономическая сторона вопроса. Стоимость проведения МАБ очень высока, так как требует длительного применения дорогостоящих препаратов.
В последнее время появились сообщения о возможности проведения прерывистого лечения, так называемой интермитирующей блокады. Результаты рандомизированных исследований еще не получены. Однако предварительные данные свидетельствуют о том, что прерывистое назначение гормональных препаратов может длительно сохранить чувствительность к антиандрогенам и улучшает качество жизни, что связывается с восстановлением сексуальной функции и уменьшением побочных эффектов от длительного применения препаратов. При данном подходе значительно снижается стоимость лечения. Интермиттирующая блокада становится популярным методом лечения распространенного рака предстательной железы, однако, еще нет убедительных данных, что такой подход имеет преимущество в отношении продолжительности жизни по сравнению со стандартными видами лечения.
На 2-й международной консультации по раку простаты (Париж,1999) обсуждалась новая стратегия “step-up”, при которой лечение начинается с монотерапии антиандрогенами, а аналоги LHRH добавляются при прогрессировании процесса (Reijke T.,1999). Все эти новые концепции пока находятся в стадии разработки, однако, они представляются прогрессивными по сравнению с принятыми стандартами.
В настоящее время большинство специалистов, занимающихся лечением больных раком предстательной железы, назначая тот или иной вид терапии, обязательно руководствуются не только стадией заболевания, но и анализом прогностических факторов, таких как уровень ПСА и динамика его изменения в процессе лечения, степень активности пациента, степень злокачественности опухоли и рядом других.
Исходя из анализа современной литературы и собственного опыта, мы рекомендуем обсудить следующую тактику первой линии лечения больных распространенным раком предстательной железы.
У больных с первично выявленным распространенным раком предстательной железы при благоприятном прогнозе (минимальное проявление болезни) – антиандрогены в стандартной дозировке.
При прогрессировании – МАБ (антиандрогены в сочетании с аналогами LHRH или хирургической кастрацией). При стабилизации процесса более 6 месяцев – интермитирующая блокада.
У больных с выраженным болевым синдромом и неблагоприятными прогностическими факторами – хирургическая кастрация, при прогрессировании – высокие дозы антиандрогенов.



.png)