Рак простаты у мужчин: прогнозы
Когда диагностируют рак простаты у мужчин, прогноз выживаемости зависит от формы рака, стадии развития опухоли, состояния здоровья и возраста больного. Выживаемость при раке простаты выше, если опухоль обнаружена на раннем этапе развития. Ранние стадии развития злокачественного новообразования относятся к локальным видам рака – опухоль не выходит за пределы органа, нет метастазов. Заболевание хорошо поддается лечению. Когда диагностирован метастазирующий рак простаты, последствия тяжелые – заболевание хуже поддается лечению, в костях, печени, легких, лимфатических узлах обнаруживаются метастазы опухоли, больной ослаблен, часто подавлен.
В Юсуповской больнице проводят лечение рака простаты на всех стадиях развития. Пациент проходит обследование у уролога, онколога, получает помощь психолога. В больнице пациент со злокачественными заболеваниями простаты может пройти диагностику на инновационном медицинском оборудовании, получить все виды медицинской помощи в зависимости от типа опухоли, стадии развития новообразования. В реабилитационном центре пациенты проходят восстановление по специальной программе для онкологических больных.

Симптомы рака простаты
Предстательная железа – это орган, состоящий из нескольких частей. Железа находится в капсуле, части железы разделены эластичными перегородками. Предстательная железа участвует в выработке семенной жидкости, которая служит питательной средой для сперматозоидов, участвует в выработке сперматозоидов, отвечает за качество спермальной жидкости, за функцию выведения спермы наружу, за эректильную функцию, за задержку мочи. Рак предстательной железы распространенное заболевание, занимающее одно из первых мест среди злокачественных заболеваний. Признаки рака простаты достаточно размыты. Из-за бессимптомности на начальных стадиях развития и схожести симптомов с симптомами аденомы простаты, рак простаты чаще диагностируют на 3-4 стадии развития, когда появляются выраженные симптомы заболевания, нарушается мочеиспускание, нарушается процесс дефекации, эрекция, появляется боль в области поясницы, низа живота, костях.
Симптомы локального рака простаты на первой стадии – это небольшое увеличение предстательной железы, изредка возникает дискомфорт во время мочеиспускания. На стадии Т1а и 1b локальные опухоли простаты не пальпируются из-за небольшого объема новообразования, чаще всего представляют собой высокодифференцированные опухоли. В некоторых случаях определяется хорошо дифференцированный рак (обнаруживаются раковые клетки менее чем в 5% исследуемых тканей). Если ПСА находится в пределах нормы, устанавливают динамическое наблюдение за больным. Локальный рак простаты может представлять собой латентную форму рака, которая никогда не переходит в клинические формы заболевания.
Рак простаты на раннем этапе обнаруживается редко, основным методом, который помогает выявить злокачественное заболевание простаты на ранней стадии, считается тест ПСА. Характеристика злокачественной опухоли простаты по стадиям:
- Стадия Т1 – опухоль может чувствоваться при пальцевом исследовании, часто не обнаруживается при трансректальном ультразвуковом исследовании.
- Стадия Т1а – в большинстве случаев рак обнаруживают при гистологическом исследовании после удаления ткани аденомы простаты. Исследование показывают небольшое содержание раковых клеток – не более 5%.
- Стадия Т1b – Раковые клетки выявлены при гистологическом исследовании после лечения аденомы простаты. В отличие от стадии Т1а в тканях простаты более 50% раковых клеток.
- Стадия Т1с – тест на ПСА показал повышенный уровень, гистологическое исследование показало наличие рака простаты.
- Стадия Т2 – опухоль чувствуется при ректальном исследовании, её диагностируют с помощью УЗИ, КТ и других методов исследования. Опухоль не выходит за пределы простаты.
- Стадия Т2а – на этой стадии рак поражает половину или чуть менее половины доли простаты.
- Стадия Т2b – раковая опухоль поражает более половины доли органа.
- Стадия Т2с – рак поражает обе доли предстательной железы.
- Стадия Т3 – опухоль выходит за пределы органа, нередко поражает семенные пузырьки.
- Стадия Т3а – рак выходит за пределы органа, но не поражает семенные пузырьки.
- Стадия Т3b – злокачественная опухоль поражает семенные пузырьки.
- Стадия Т4 – опухоль выходит за пределы простаты, поражает мышцы мочевого пузыря, прямую кишку, стенку таза и другие органы, и ткани.
Лечение рака предстательной железы
Лечение рака на стадиях Т1с-Т2с проводится в зависимости от возраста больного. Хирургическое лечение рака простаты не показано мужчинам после 70 и старше. Не назначают хирургическое лечение пожилым мужчинам с сопутствующими раку простаты тяжелыми заболеваниями, при наличии высокодифференцированной опухоли. В большинстве случаев радикальная простатэктомия назначается молодым мужчинам. В старшем возрасте поддержка больного проводится с помощью лучевой терапии и химиотерапии. При повышении уровня ПСА после радикальной простатэктомии назначают адъювантную терапию. Повышение уровня ПСА указывает на развитие рецидива опухоли простаты или метастазы.
Третья стадия рака простаты характеризуется появлением стойкого нарушения мочеиспускания из-за увеличения простаты, располагающейся вокруг уретры. После проведения радикальной операции назначают адъювантную лучевую терапию при Т3 с показателями суммы Глисона больше 7 баллов, уровня ПСА более 10, если доказан местный рецидив опухоли простаты. Лучевая терапия показана пациентам с локальными формами рака простаты на первой и второй стадии заболевания, в случае невозможности или нежелания проведения хирургического лечения, а также больным со стадией Т3 и отсутствием метастазирования опухоли в регионарные и отдаленные лимфоузлы. Для проведения лучевой терапии пациент должен иметь прогноз долгой продолжительности жизни. Для повышения эффективности используют комбинированное лечение: лучевая терапия + гормональная терапия.
Использование адъювантной гормональной терапии оправдано у пациентов с диплоидными опухолями. Для лечения Т1-Т2 также применяют брахитерапию – облучение простаты путем введения радиоактивных гранул. Пациентам со стадией Т3 брахитерапию проводят в комплексе с наружным облучением. В случае если опухоль простаты обнаружена у мужчины в возрасте, при наличии сопутствующих тяжелых заболеваний, высокодифференцированном раке простаты в стадии Т1а, Т1с оправдано динамическое наблюдение. В случае прогрессирования опухоли принимается решение о методах лечения с учетом возраста, состояния здоровья больного.
3 степень: продолжительность жизни
При обнаружении 3 стадии рака простаты прогноз зависит от наличия или отсутствия метастазирования опухоли, распространенности процесса, агрессивности рака предстательной железы. Прогноз при средней тяжести заболевания ставить сложнее, чем при ранних стадиях рака. Прогноз на поздних стадиях неблагоприятный, четвертая стадия заболевания относится к неизлечимой стадии рака. Рак предстательной железы 3 стадия – прогноз выживаемости в течение пяти лет после проведения лечения составляет 40%.
2 степень: продолжительность жизни
Рак простаты 1 степени – продолжительность жизни (в течение пяти лет) после лечения рака составляет 90%. Рак простаты 1 степени хорошо поддается лечению, но обнаружение опухоли редко происходит на первой стадии развития. В большинстве случаев рак диагностируют во время гистологического исследования тканей после резекции аденомы простаты, а также с помощью теста ПСА.
Прогноз выживаемости при онкологии простаты
Рак предстательной железы – это тяжелое заболевание, которое бессимптомно протекает на ранних стадиях развития, агрессивные опухоли простаты развиваются стремительно, быстро приводят к смерти больного. Прогноз выживаемости при раке рассчитывается исходя из пятилетнего срока, в зависимости от стадии и агрессивности опухоли определяется прогноз пятилетней выживаемости больного. Прогноз составлен на основании выживаемости определенного процента пациентов после постановки первичного диагноза. В прогноз выживаемости не вошли пациенты, у которых в течение пятилетнего срока произошли рецидивы рака.
Прогноз выживаемости имеет показатель относительной выживаемости. Расчет относительной выживаемости проводился по пациентам, которые страдали раком определенной локализации, а смерть наступила от сопутствующих раку заболеваний. Для прогноза выживаемости важны такие критерии, как стадия рака, локализация опухоли, возраст, пол, чувствительность к препаратам, наличие сопутствующих заболеваний.
2 степень: продолжительность жизни
Рак предстательной железы 2 степени – продолжительность жизни в течение пяти лет составляет 80%. Выживаемость при раке простаты 2 стадии высокая, опухоль хорошо поддается лечению на этой стадии, успех лечения рака зависит от опыта врача-онколога, эффективности назначенного лечения.
Средняя продолжительность жизни
Продолжительность жизни больных раком простаты зависит от многих факторов: состояния здоровья больного, стадии рака, психологического состояния больного, эффективности лечения и многих других составляющих прогноза выживаемости. Часть больных излечивается полностью на ранних стадиях развития рака, у части больных происходят рецидивы, рак метастазирует – прогноз выживаемости ухудшается. При своевременном обращении к врачу продолжительность жизни составляет 15 и более лет. Неблагоприятный прогноз для рака простаты 4 степени: продолжительность жизни при постоянном паллиативном лечении не более 7 лет. Рак предстательной железы 4 степени – продолжительность жизни в течение пяти лет отмечена у 15% больных.
Гормонозависимая злокачественная опухоль простаты – срок жизни
Повышение уровня тестостерона в организме мужчины может привести к развитию гормонозависимого рака предстательной железы. Прогноз выживаемости при такой форме рака негативный. Опухоль отличается быстрым прогрессом, при появлении метастазов продолжительность жизни при раке простаты этого типа составляет не более 3-4 лет. Если обнаружена онкология предстательной железы, прогноз выживаемости составляется после полного обследования пациента, постановки диагноза.
В Юсуповской больнице проводится комплексная диагностика рака простаты. Определяется вид злокачественного заболевания и стадия развития опухоли. Диагностика заболевания проходит с помощью различных методов исследования:
- Тест ПСА. Проводится анализ крови на онкомаркер рака предстательной железы. Этот анализ позволяет выявить злокачественную опухоль на первой стадии развития. Ежегодно анализ назначают мужчинам, которые имеют наследственную предрасположенность к раку простаты.
- Проводится осмотр пациента врачом-урологом или онкологом. Врач выполняет ректальную пальпацию, определяя наличие образования, его локализацию, размер.
- Назначается трансректальное УЗИ предстательной железы.
- Для определения степени прорастания опухоли в соседние ткани, наличия метастазов в регионарных или отдаленных лимфатических узлах и органах врач направляет пациента на МРТ, КТ или ПЭТ-КТ исследования.
- После проведенных исследований назначают биопсию тканей простаты, пораженных опухолью.
В зависимости от показателей исследований, возраста, состояния здоровья пациента врач-онколог назначает лечение. В онкологическом отделении больницы применяют инновационные методы лечения рака простаты. Записаться на консультацию к врачу можно по телефону.
Дифференциальная диагностика рака простаты
Онкологические изменения предстательной железы являются распространенной причиной смерти у мужчин старшего возраста. Злокачественное перерождение плохо идентифицируется на ранних стадиях, которые протекают бессимптомно. Часто пациент обращается, когда болезнь уже прогрессирует и доставляет ощутимый дискомфорт. Своевременную диагностику гиперплазии и рака простаты вы можете пройти в Государственном центре урологии. Клиника располагает современным оборудованием, которое обеспечит комплексное точное обследование.
Методы диагностики
Чтобы идентифицировать онкологическое перерождение современная медицина используется несколько методов. Диагноз ставится по совокупности данных. Выбор исследования зависит от анамнеза пациента и его фактического состояния:
определение уровня ПСА;
пальцевое обследование железы;
общий анализ плюс посев мочи;
методы визуализирующей диагностики.
Дополнительно врач может назначить урофлоуметрию и УЗИ мочеполовой системы с целью исключения опухоли в мочевом пузыре.
Дифференциальная диагностика рака простаты начинается анализом крови на простатит-специфический антиген. Тест должны периодически проходить все мужчины по достижению сорокалетия. Для каждой возрастной группы существует своя норма антигенов. Важно знать, что повышение показателей может свидетельствовать не только о раке предстательной железы, но и об аденоме или простатите.
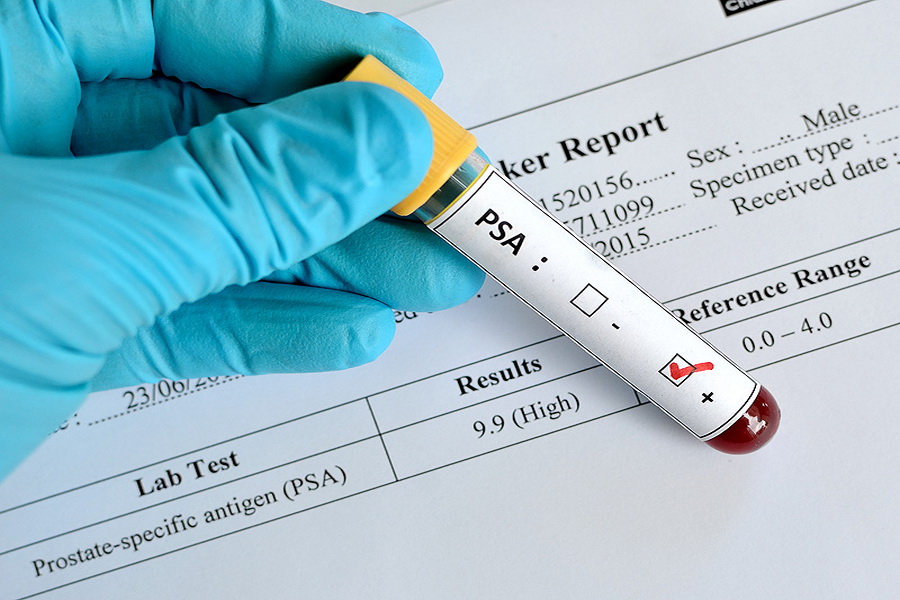
Результаты ПСА обязательно трактует квалифицированный врач, повышение данного параметра не может служить однозначным доказательством онкологических изменений.
Пальцевой осмотр
Эффективным методом диагностики рака простаты является пальцевое обследование через прямую кишку. При осмотре врач оценивает размеры железы, ее структуру, наличие твердых и каменистых включений. Также учитываются симметричность органа и его бугристость.
Данный метод позволяет обнаружить патологию у тех мужчин, чей уровень ПСА не повышен.
Диагноз рак простаты ставят после ультразвукового исследования. Практикуют два вида процедуры: трансабдоминальная и трансректальная.
Первый способ предполагает стандартное исследование, когда датчик прибора помещается на нижнюю часть живота. При таком способе УЗИ предстательная железа визуализируется не очень четко, при обнаружении опухоли невозможно оценить ее размеры и положение.
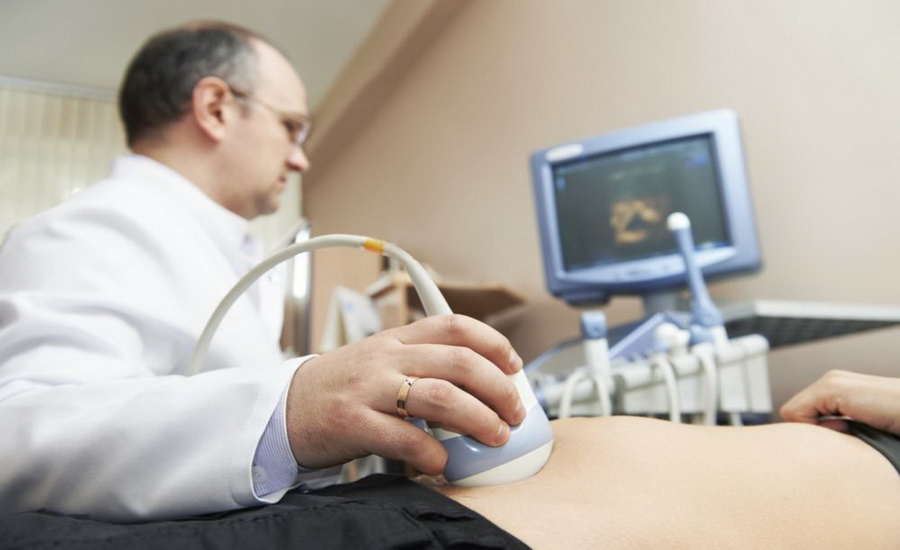
Чтобы уточнить информацию, специалист назначит трансректальное исследование. В ходе него специальный датчик вводится в прямую кишку мужчины. Поскольку простата находится около передней стенки прямой кишки, исследование очень информативно. Дополнительно врач может провести допплерографию или дуплексное сканирование, что позволит оценить качество кровотока в железе и в опухоли.
Забор биопсии
Дифференциальная диагностика ДГПЖ и рака простаты невозможна без гистологического исследования. Анализ позволяет точно диагностировать онкологическое перерождение органа. Биопсия предусматривает забор ткани предстательной железы. В лаборатории полученный образец проверяют на наличие раковых клеток, при их обнаружении подтверждается диагноз.
Процедура проводится с участием ультразвукового прибора. Специалист вводит иглу через стенку кишечника в предстательную железу. В полой части иглы остается небольшой участок ткани железы, его достаточно, чтобы провести анализ. Иногда инвазию производят через кожу в промежутке между мошонкой и анусом.
Для достоверности специалист выполняет несколько уколов. Процедура доставляет небольшой дискомфорт и можно попросить врача проводить ее под местной анестезией. После для предупреждения инфекции назначают антибиотики. Среди последствий биопсии: дискомфорт в промежности, незначительное количество крови в моче, кале, сперме.
Визуализация
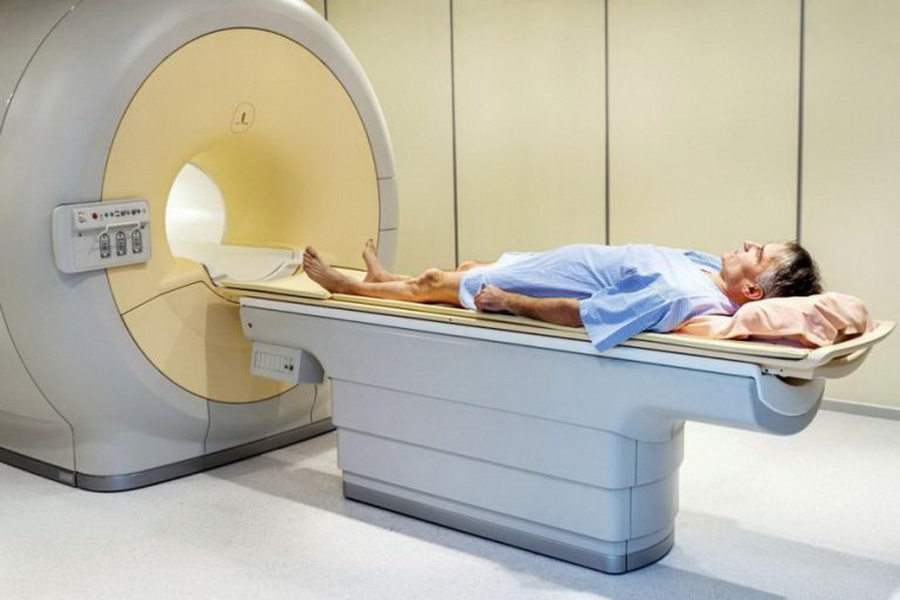
Диагностика рака простаты у мужчин выполняться с помощью таких исследований как КТ и МРТ. Они позволяют точно определить размеры опухоли, ее локализацию, степень поражения близлежащих тканей.
Квалифицированную медицинскую помощь и комплексную диагностику предстательной железы вы можете получить в Государственном центре урологии. У нас работают лучшие специалисты столицы, которые располагают необходимым современным оборудованием для проведения всестороннего обследования.
Акопян Гагик Нерсесович – врач уролог, онколог, д.м.н., врач высшей категории, профессор кафедры урологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова
Алгоритм ранней диагностики рака предстательной железы
Для цитирования: Пушкарь Д.Ю., Бормотин А.В., Говоров А.В. Алгоритм ранней диагностики рака предстательной железы. РМЖ. 2003;8:483.
МГМСУ им. Н.А. Семашко
Список сокращений:
РПЖ – рак предстательной железы
РПЖ – рак предстательной железы
ПСА – простат–специфический антиген
ПРИ – пальцевое ректальное исследование
ТРУЗИ – трансректальное ультразвуковое исследование
ДГПЖ – доброкачественная гиперплазия простаты
Эпидемиология рака предстательной железы
Проблема рака предстательной железы приобрела на сегодняшний день особую актуальность вследствие неуклонного роста заболеваемости и смертности, а также в связи с трудностями своевременной диагностики. Рак предстательной железы (РПЖ) в настоящее время является одним из наиболее широко распространенных злокачественных новообразований у мужчин. Так, в США в 2001 году было зарегистрировано 198100 новых случаев рака предстательной железы и 31500 человек умерли от этого заболевания [1]. В России в 1999 г. зарегистрировано 10735 новых случаев РПЖ, а заболеваемость составила 15,69 на 100 тысяч мужского населения. В Москве заболеваемость выросла с 11,1 случаев на 100 тысяч мужского населения в 1996 г. до 26,8 случаев в 2000 году [2]. Смертность от РПЖ составляет 3,9% в структуре общей смертности от онкологических заболеваний. На долю локализованных форм РПЖ, когда возможно проведение радикального противоопухолевого лечения, приходится только 31,5% всех выявленных случаев болезни; у 68,5% больных диагностируются местнораспространенные и генерализованные формы опухолевого процесса [3].
Диаграмма 1. Количество случаев рака простаты в различных возрастных группах.
Вероятность обнаружения рака простаты у мужчины в возрасте от 40 до 59 лет составляет 1 к 78 (1,28 %), в возрасте от 60 до 79 – 1 к 6 (15,6 %). В целом около 3% мужчин подвержены риску умереть от рака предстательной железы.
Столь широкое распространение рака простаты ставит его в ряд наиболее важных социальных проблем современности. Надо полагать, что в нашей стране ситуация не лучше, хотя таких угрожающих статистических данных нет. Это, скорее всего, связано с отсутствием системы ранней диагностики и медицинского просвещения населения. Основная масса пациентов, которые попадают в нашу клинику, имеют запущенные стадии рака простаты, что не позволяет полностью избавить их от этого заболевания. Сегодня рак предстательной железы является предметом тщательного изучения. Болезнь практически не возникает раньше 40 лет и становится все более частым явлением с каждым последующим десятилетием жизни. Самое коварное в этом заболевании то, что практически отсутствуют ранние симптомы болезни. На данный момент способов полного излечения распространенного рака простаты нет. Надежды сократить число смертей от рака простаты основаны на двух тактиках – ранней диагностике и эффективном лечении болезни в ее начальной стадии.
Время от доклинического течения до установки диагноза рака простаты может быть относительно длинным. Обычно рак предстательной железы отличается медленным ростом, минимальной симптоматикой и низким потенциалом метастазирования [4]. Множество злокачественных опухолей простаты никогда не вызывают симптоматики и клинически незначимы. Данные аутопсий показывают, что около трети мужчин старше 50 лет и около 2/3 старше 70 лет имеют асимптоматический и клинически незначимый рак простаты [5]. Это делает рак предстательной железы уникальным по малигнизации с очень большим преобладанием гистологически не выявленных опухолей, но с относительно низким числом клинических проявлений.
Естественное старение населения в сочетании с внедрением в широкую практику современных диагностических тестов, таких как определение простат–специфического антигена (ПСА) сыворотки крови, привело к увеличению выявляемости локализованных форм рака предстательной железы. Это вызвало появление множества публикаций, направленных на определение роли ранней диагностики РПЖ в улучшении качества жизни мужского населения. Несмотря на то, что у скрининга РПЖ много сторонников, результаты большинства научных работ показывают, что нецелесообразно подвергать скринингу все мужское население старше 50 лет, так как недостаточно данных, что это ведет к увеличению продолжительности и качества жизни. Цель скрининга РПЖ – выявление «бессимптомных» мужчин с локализованным раком простаты, которые наиболее подходят для радикального вмешательства. Успех скрининга зависит от таких факторов, как биологические особенности и клиническое течение опухолевого процесса, методов исследования, их чувствительности, специфичности и правильного выбора критериев эффективности.
Значительные усилия направлены, во–первых, на выявление рака простаты на ранних стадиях, во–вторых, на предотвращение метастазирования или рецидива рака. Широко применяются различные методики скрининга, такие как пальцевое ректальное исследование (ПРИ), трансректальное ультразвуковое исследование (ТРУЗИ), определение различных изоформ простат–специфического антигена, а также биопсия простаты под контролем ТРУЗИ. Но ни одна из технологий диагностики, существующих в настоящее время, не способна точно определить наличие у пациента локализованной формы рака предстательной железы. Неточность клинического стадирования такова, что примерно у 30% пациентов с раком предстательной железы, определенным как Т1/Т2, на самом деле имеются стадии Т3/Т4 [6,7]. «Позитивный хирургический край» обнаруживается у 10–20% пациентов, клинически «стадированных», как Т1 и у 30–60%, классифицированных, как Т2 [8]. В течение 5 лет после хирургического вмешательства у пациентов с «негативным хирургическим краем» шанс прогрессии заболевания составляет 20% (рост ПСА и клинические проявления), в то время как у пациентов с «позитивным хирургическим краем» шанс составляет от 40% до 60% [9,10,11,12,13].
Клинические проявления рака предстательной железы
Каких–либо специфических клинических проявлений, свойственных только раку предстательной железы, не существует. Благодаря внедрению в широкую медицинскую практику современных методов ранней диагностики, все чаще рак предстательной железы диагностируется на ранних стадиях, когда больные практически не предъявляют жалоб. В начале заболевания больные могут обратиться к врачу с жалобами на эректильную дисфункцию. В этой связи назначение в качестве стимуляторов андрогенов категорически противопоказано без обследования предстательной железы на наличие онкологического заболевания. На более поздних стадиях заболевания у больных могут появиться уродинамические нарушения, схожие с таковыми при доброкачественной гиперплазии простаты (ДГПЖ). Наиболее часто встречающиеся симптомы отражены в таблице 1.
Диагностика рака предстательной железы
Пальцевое исследование прямой кишки
Пальцевое исследование прямой кишки – самый простой, дешевый и безопасный метод диагностики рака предстательной железы. Однако результаты исследования во многом определяются размерами опухоли и ее локализацией. Данные, полученные при пальпации, не всегда легко интерпретировать, но малейшее подозрение является веским основанием для дальнейшего обследования больного. В среднем только у одной трети пациентов с наличием пальпируемых участков, подозрительных на РПЖ, впоследствии морфологически верифицируют злокачественную опухоль простаты.
Пальцевое исследование прямой кишки – самый простой, дешевый и безопасный метод диагностики рака предстательной железы. Однако результаты исследования во многом определяются размерами опухоли и ее локализацией. Данные, полученные при пальпации, не всегда легко интерпретировать, но малейшее подозрение является веским основанием для дальнейшего обследования больного. В среднем только у одной трети пациентов с наличием пальпируемых участков, подозрительных на РПЖ, впоследствии морфологически верифицируют злокачественную опухоль простаты.
Немаловажную роль играет то, что правильность ПРИ во многом зависит от квалификации и опыта исследователя. Часто наблюдается недооценка стадии, поскольку небольшие, расположенные в передних отделах железы опухоли, как правило, не пальпируются; ложноположительные результаты наблюдаются у больных с гиперплазией предстательной железы и простатитом. Этот метод, однако, позволяет выявить рак предстательной железы, когда уровень ПСА остаётся в пределах нормы, и представляет хотя не точные, но полезные данные о стадии заболевания. С учетом современных возможностей данные ПРИ необходимо оценивать в комплексе с определением уровня ПСА и данными ТРУЗИ.
Ультразвуковое исследование
Ультразвуковое исследование получило наибольшее распространение в диагностике заболеваний предстательной железы. Особенно интерес к исследованию проявился с введением трансректального ультразвукового исследования. Около половины опухолей более 1 см в диаметре выявляются с помощью ультразвука. На основании опыта, суммированного R.L. Waterhouse и M.I. Resnick [14], было выявлено, что ТРУЗИ имеет низкую чувствительность и специфичность по отношению к оценкам, необходимым для скрининга. Чувствительность была в пределах от 71% до 92% для карциномы простаты и от 60% до 85% для субклинических стадий болезни. Специфичность колебалась в пределах от 49% до 79%. Исследование имело прогностическое значение в 30% случаев. Чувствительность и положительное прогностическое значение для ТРУЗИ, как отдельного метода, были лучше, чем для пальцевого ректального исследования. Частота выявления рака среди ТРУЗИ–позитивных пациентов, у которых не выявлено изменений по данным ПРИ и исследования уровня ПСА, значительно ниже. В связи с низкой специфичностью и чувствительностью ТРУЗИ отошел на роль вспомогательного диагностического метода, используемого при наличии изменений в скрининговых тестах.
Простат–специфический антиген
В настоящее время наиболее ценным опухолевым маркером, исследование которого в сыворотке крови необходимо для диагностики и наблюдения за течением доброкачественной гиперплазии и рака предстательной железы, является простат–специфический антиген. Начиная с 1987 г., ПСА широко используется в диагностике рака простаты, установлении стадии процесса, оценке эффективности лечения. Определение уровня ПСА увеличило частоту выявления рака простаты на ранних стадиях, многие из которых могут быть излечены радикально.
Простат–специфический антиген – гликопротеин, вырабатываемый секреторным эпителием простаты и служащий для разжижения эякулята. В сыворотке крови ПСА находится в двух формах: свободной и связанной с различными антипротеазами. По причине того, что ПСА является белком, вырабатываемым в нормальной предстательной железе, он не является специфичным по отношению к заболеванию. Иными словами, повышение уровня ПСА может быть обусловлено целым рядом причин, среди которых наиболее значимыми являются следующие:
- Рак простаты
- Доброкачественная гиперплазия простаты
- Наличие воспаления или инфекции в простате
- Ишемия или инфаркт простаты.
Таким образом, повышение уровня простат–специфического антигена в крови не всегда свидетельствует о наличии злокачественного процесса.
Нормальным считается содержание общего ПСА менее 4 нг/мл, повышение уровня ПСА более 4 нг/л уже является показанием для проведения детального обследования для исключения наличия рака простаты даже при нормальных данных ПРИ. При высоких цифрах общего ПСА биопсию предстательной железы проводят в обязательном порядке. Прогностическая ценность определения ПСА была значительно выше у пациентов, у которых при пальцевом ректальном исследовании имелись изменения, подозрительные на рак простаты.
Тест на ПСА становится высокочувствительным только при значениях более 20 нг/мл. Для проведения радикального лечения рака простаты необходимо выявление этого заболевания на ранних стадиях, а подавляющее большинство случаев локализованного рака приходится на так называемую «серую зону», когда значения ПСА находятся в промежутке 4–10 нг/мл. С целью повышения диагностической ценности теста ПСА, особенно в случае диагностического поиска ранних стадий опухоли, используется следующий ряд индексов: отношение свободный/общий ПСА (f/t ПСА), отношение ПСА к объему предстательной железы (ПСА D), скорость прироста ПСА (ПСА V) и некоторые другие параметры.
С возрастом отмечается повышение уровня ПСА, что объясняется увеличением объема предстательной железы за счет роста аденомы простаты. Поэтому на значение ПСА оказывает влияние не только возраст, точнее сказать, не столько возраст, сколько объем предстательной железы. Учитывать влияние увеличенного объема предстательной железы на показатель ПСА необходимо и из–за того, что рак предстательной железы почти в половине случаев встречается одновременно с доброкачественной гиперплазией предстательной железы. Для этой цели используется индекс ПСА D, который вычисляется по формуле:
ПСА D = ПСА (нг/мл)/ Объем простаты (см 3 )
Этот показатель увеличивает специфичность показателя общего ПСА сыворотки крови. Объем предстательной железы определяется при трансректальном ультразвуковом исследовании. При этом значение индекса ПСА D не должно превышать 0,15 нг/мл/см 3 . Значение ПСА D, большее этой величины, является одним из показаний к выполнению биопсии предстательной железы.
Оценка скорости изменения ПСА со временем (ПСА V) является ценным методом определения риска появления рака простаты. Этот тест высокоспецифичен и основан на длительном измерении уровня ПСА. Лишь у 5% пациентов, у которых нет рака простаты, определяется ПСА V, как и при РПЖ. Для получения максимальной пользы от параметра ПСА V должны быть оценены по следние три показателя за 2–х летний период или, по крайней мере, данные с интервалом 12–18 месяцев. Показатель ПСА V і 0,75 нг/мл/год весьма характерен для рака простаты.
В дополнение к оценке уровня общего ПСА сыворотки крови определение различных форм ПСА несет полезную дополнительную информацию, особенно в случае повышения общего ПСА в пределах «серой шкалы» с учетом индивидуальных особенностей каждого пациента. Уровень общего ПСА сыворотки крови определяется сложением показателей свободного ПСА и ПСА, связанного с белками плазмы. Соотношение уровня свободного ПСА к уровню общего ПСА (f/t ПСА), выраженное в процентах, обозначается, как процент свободного ПСА. Этот показатель вычисляется по формуле:
f/t ПСА =( ПСА свободный / ПСА связанный ) х 100 %
Для мужчин, у которых показатель f/t ПСА менее 15%, рекомендуется выполнение биопсии простаты, при значении f/t ПСА более 15% риск наличия РПЖ ниже и иногда биопсия простаты может быть отсрочена или совсем не выполняться. Прогностическая ценность соотношения f/t ПСА увеличивается с ростом уровня общего ПСА и становится наибольшей при уровне общего ПСА больше 6–8 нг/мл.
Биопсия простаты
Подозрение на рак предстательной железы (повышение ПСА, наличие суспициозных участков в ткани простаты при ректальном осмотре, обнаружение гипоэхогенных участков при ультразвуковом исследовании или их сочетание) является показанием к выполнению одного из завершающих этапов диагностики – биопсии простаты (рис. 1).
Рис. 1. Трансректальная биопсия простаты под ультразвуковым наведением
Мультифокальная трансректальная биопсия, выполняемая под ультразвуковым наведением или под пальцевым контролем, является одним из наиболее надежных способов диагностики рака простаты. Методика трансректальной биопсии предстательной железы заключается в том, что при помощи специальной высокоскоростной автоматической иглы (т.н. «биопсийного пистолета») через прямую кишку берутся нитевидные кусочки ткани простаты, которые впоследствии отправляются на морфологическое исследование.
В клинике урологии МГМСУ разработана методика выполнения биопсии простаты по расширенной схеме. Согласно нашим данным, при увеличении количества пункций простаты и более латеральном направлении вколов игл при биопсии отмечается статистически достоверный рост вывляемости рака, причем главным образом – за счет локализованных форм. В зависимости от возраста пациента, уровня простат–специфического антигена и ряда других факторов во время биопсии берется от 6 до 18 кусочков ткани предстательной железы. Грамотно выполненное морфологическое исследование биоптатов является залогом успешного лечения. Наряду с делением карциномы простаты по степени дифференцировки на высоко–, умеренно– и низкодифференцированную в последние годы широкое распространение получила оценка дифференцировки по схеме D.F. Gleason (1977) [15]. Она основана прежде всего на гистологических критериях. Применение шкалы Глисона позволяет распределить пациентов на группы прогноза для определения оптимального способа лечения. Сумма Глисона оказалась чрезвычайно точным прогностическим признаком, особенно значимым является показатель 7 баллов и более, свидетельствующий о высоком проценте инвазии капсулы простаты, семенных пузырьков и метастатического поражения лимфатических узлов.
Гетерогенная природа РПЖ делает его трудным для оценки объема поражения. Определение ПСА не имеет достаточной специфичности и чувствительности для предсказания клинической и патологической стадии процесса [16]. Комбинация с другими показателями, такими как шкала Глисона, данные ПРИ, улучшает прогностическую информацию и позволяет наиболее точно установить клиническую стадию РПЖ.
Введение программ скрининга приводит к увеличению выявляемости случаев рака простаты на тех стадиях, когда возможно полное избавление больных от этого заболевания при своевременном лечении. По результатам патоморфологической оценки образцов простатэктомии приблизительно 60% пациентов с клинически локализованным раком простаты имеют опухоль, ограниченную органом. Согласно обобщенным данным, распространение ракового процесса за пределы простаты и наличие позитивного хирургического края имеют негативное значение для прогрессии и выживаемости. В связи с этим важно прогнозировать риск распространения опухоли за пределы органа. Проведены многочисленные исследования, направленные на предсказание патологической стадии опухоли на основании определения совокупности множества критериев. Наибольшую популярность среди всех алгоритмов предсказания клинической стадии РПЖ получили номограммы, представленные A.W. Partin с соавт. [17,18]. В их основу положены такие показатели, как уровень ПСА, клиническая стадия и степень дифференцировки опухоли по шкале Глисона.
На основании накопленного опыта обследования больных с различными жалобами на нарушение мочеиспускания в клинике урологии МГМСУ разработан алгоритм ранней диагностики РПЖ, который представлен ниже. Мы надеемся, что он в значительной степени облегчит работу врача и приведет к повышению выявляемости РПЖ на ранних стадиях.
Схема 1. Алгоритм ранней диагностики рака предстательной железы
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Диагностика рака простаты
В большинстве случаев диагностика рака простаты проводится мужчине на этапе профилактического осмотра (скринингового обследования) по месту работы. Самым простым способом в данном случае является исследование анализа крови на уровень простат-специфического антигена (ПСА) и пальцевое ректальное исследование предстательной железы.
История жизни и заболеваний
Если врач подозревает, что у вас есть рак предстательной железы, он подробно расспросит об имеющихся у вас симптомах заболевания, например, проблемах с мочеиспусканием или сексуальной активностью. Кроме того врача будет интересовать и то, как давно вас беспокоят симптомы.
Во время консультации доктор проведет общий осмотр для оценки вашего общего состояния, а также выполнит исследование предстательной железы через прямую кишку. Изменение размера, консистенции простаты или наличие узлов может свидетельствовать о патологии.
Обязательный этап диагностики рака простаты

ПСА – это белковое соединение, которое образуется в предстательной железе и далее выделяется в кровь. Уровень ПСА в эякуляте в 106 раз выше, чем в крови. Его функция заключается в поддержании необходимой консистенции спермы. Высокий уровень ПСА может быть признаком рака предстательной железы. Важно понимать, что ПСА – это тканевой, а не опухолевый маркер, т.е. его уровень может повышаться и при других не злокачественных патологических процессах, таких как инфекция мочеполовой системы, простатит или аденома простаты. ПСА в крови существует в нескольких состояниях – свободном и связанном с белками крови. Сумма свободного и связанного ПСА составляет общий уровень ПСА в крови.
Норма ПСА крови варьирует, что обусловлено возрастом мужчины и размерами предстательной железы. Уровень ПСА повышается с возрастом. Диагностика рака предстательной железы, а точнее скрининг, должны проводиться каждому мужчине ежегодно, однако на деле оказывается далеко не так. Зачастую мужчины вынуждены самостоятельно сдавать ПСА. В нашей стране принята единая норма ПСА, которая равна 4 нг/мл. Однако существует множество исследований говорящих от том, что норма ПСА не должна быть одинакова для всех возрастов. Одна из известных таблиц ПСА указана ниже.
ПСА в норме:
Возраст в годах
Верхняя граница нормы ПСА (нг/мл)
Часто бывает так, что ПСА выше этих цифр, но меньше 10 нг/мл свидетельствуют о наличии доброкачественной гиперплазии предстательной железы у мужчины. Уровень ПСА выше 10 нг/мл также может быть ассоциирован с аденомой простаты, но чем выше показатель, тем выше риск рака простаты. Иногда опухоль предстательной железы может диагностироваться у мужчин с нормальным уровнем ПСА (ложно-отрицательный тест). Однако в большинстве случаев на момент обнаружения рака предстательной железы у мужчины определяется уровень ПСА в десятки, сотни, или даже тысячи раз выше нормы. Чем выше уровень ПСА, тем более вероятно раннее метастазирование опухоли. Уровня ПСА может косвенно значение для определения стадии опухолевого процесса (смотрите тему «Стадии рака простаты»).
Уровень ПСА от 4 до 10 нг/мл определяется как серая диагностическая зона, т.е. врач не может предугадать, связан ли этот подъем с опухолью или аденомой предстательной железы. Это в свою очередь часто приводит к ненужному назначению биопсии. Определение соотношения свободный/общий ПСА помогает врачу отобрать мужчин, нуждающихся в проведении биопсии простаты и снизить количество ненужных биопсии.
Соотношение свободный/общий ПСА используется врачами для дифференциальной диагностики между аденомой и злокачественной опухолью. Аденома предстательной железы сопровождается выработкой большого количества свободного ПСА, в то время как рак ассоциирован с высоким уровнем связанного ПСА. Кроме того соотношение свободный/общий ПСА является важным ранним индикатором развития злокачественного процесса. Высокий уровень свободного ПСА (более 25%) в большинстве случаев свидетельствует о наличие доброкачественной гиперплазии предстательной железы. Низкий уровень свободного ПСА (ниже 15%) сигнализирует о раке простаты. Все мужчины с уровнем свободного ПСА менее 7% имеют высокий риск наличия злокачественного процесса, и должны обязательно проходить процедуру биопсии простаты.
Соотношение свободный ПСА/общий ПСА >0,15, как правило, свидетельствует о наличии у пациента аденомы простаты. Соотношение
Вероятность положительной диагностики рака простаты при биопсии в зависимости от соотношения свободный/общий ПСА:
Свободный/общий ПСА
50-59 лет
60-69 лет
≥ 70 лет
Мониторинг уровня ПСА в крови также помогает оценить эффективность лечения рака простаты и решить вопрос о необходимости дополнительных лечебных опций. Если уровень ПСА стабилен, это признак того, что опухоль не растет и не метастазирует. При излечении рака простаты раковые клетки разрушаются, а уровень ПСА падает.
Также при диагностике рака простаты могут использоваться и другие производные значения ПСА, такие как плотность, скорость нарастания/удвоения ПСА.
Тест на уровень простат-специфического антигена может давать как ложно-положительные, так и ложно-отрицательные результаты при диагностике рака простаты, что не всегда позволяет исключить злокачественное образование у пациента и требует назначения такой процедуры, как биопсия предстательной железы.
Пальцевое ректальное исследование в диагностике рака простаты

Пальцевое ректальное исследование – важное составляющее ранней диагностики рака простаты. Так как предстательная железа расположена по передней поверхности прямой кишки, она доступна пальпации при ректальном исследовании.
Пальцевое ректальное исследование не требует какой-либо анестезии. Обследование может производиться в различных позах. Наиболее удобная позиция, как для врача, так и для пациента – на боку с ногами согнутыми в коленных и тазобедренных суставах. Также обследование может проводиться в следующих положениях: в колено-локтевой позе, лежа на спине в гинекологическом кресле с приведенными к животу ногами. Как правило, традиционной и что немаловажно менее “унизительной” является исследование через прямую кишку, когда пациент лежит на боку с приведенными к животу ногами.
После того как врач одевает стерильные перчатки, он осторожно медленно вводит палец, смазанный вазелином или гелем, в прямую кишку. Через несколько секунд анальный сфинктер расслабляется, и испытываемый в начале исследования дискомфорт уменьшается. Обследование начинается с верхушки предстательной железы по направлению к основанию. Оценивается размер и форма простаты, консистенция, наличие узлов или уплотнений. Злокачественное образование определяется как плотный узел расположенный, как правило, в периферической зоне железы. Нормальный объем простаты у мужчин молодого возраста составляет в среднем не более 30 куб.см., консистенция эластическая. Отметим тот факт, что при пальцевом ректальном исследовании пальпации доступна лишь задняя стенка простаты, следовательно, патологические образования, расположенные в центре, верхушке или передней части не могут быть определены врачом. Именно поэтому скрининг рака простаты кроме пальцевого ректального исследования подкрепляется анализом на ПСА, УЗИ, при необходимости МРТ.
Трансректальное ультразвуковое исследование в диагностике рака простаты
Трансректальное ультразвуковое исследование простаты – это 5-ти – 15-ти минутное амбулаторное исследование, использующее ультразвуковые волны для создания видео-изображения исследуемого органа на экране монитора. Суть трансректального ультразвукового исследования заключается во введении в прямую кишку ультразвукового датчика, посылающего эхо-волны к предстательной железе. Отраженные тканями простаты волны, обрабатываются компьютером и транслируются на мониторе в виде изображения. Наиболее широко для УЗИ простаты применяется ректальный датчик с частотой 7 МГц, длиной не более 15 см, диаметром не более 15 мм. Трансректальное ультразвуковое исследование может приносить дискомфорт мужчине, особенно в момент введения датчика в прямую кишку, но сама по себе процедура абсолютно безболезненна. Несмотря на то, что трансректальное ультразвуковое исследование не может выявить любую опухоль, оно обладает большей диагностической ценностью, чем ректальное пальцевое обследование. Трансректальное ультразвуковое исследование позволяет оценить размер, форму, границы и консистенцию простаты, наличие патологических образований.

Перед УЗИ пациенту необходимо сделать клизму для очищения прямой кишки от каловых масс и газов. Клизму можно сделать самостоятельно в домашних условиях перед отправлением в клинику. Исследование выполняется в положении пациента лежа на левом боку, такая позиция наиболее удобна для мужчины и обеспечивает более легкое введение датчика через анальное отверстие. Перед введением на датчик одевается презерватив и смазывается гелем. Ректальный датчик посылает волны к простате, нормальные и аномальные ткани отражают эти волны по-разному. Врач оценивает эхогенность исследуемой структуры, которая зависит от ее морфологического строения.

В норме волны, отражающиеся от предстательной железы, являются изоэхогенными. Гипоэхогенные зоны в железе отражают намного меньше эхо-волн, и могут свидетельствовать о наличии опухолевого процесса.
Для диагностики рака простаты могут использоваться и другие методы, например, компьютерная томография или магнитно-резонансная томография, которые особенно ценны для диагностики распространенного и метастатического рака простаты.
В личной практике мы так же проводим эластографию, особенно когда есть спорные данные. В таких случаях эластография является очень полезным методом в комплексной диагносте рака простаты. Данный метод построен на основании ультразвуковых волн. Результатом является составление карт сканируемого органа с указанием очагов. Так же данный метод позволяет более точно выполнять биопсию предстательной железы.
Биопсия простаты

Биопсия простаты – «золотой стандарт» диагностики рака предстательной железы.
Биопсия простаты – это процедура получения тканей предстательной железы и исследование их под микроскопом для оценки степени дифференцировки клеток. Раковые клетки под микроскопом выглядят отлично от здоровых клеток. Чем меньше раковые клетки похожи на здоровые (т.е. плохо дифференцированы), тем более агрессивнее опухоль предстательной железы.
Биопсия может давать ложно-отрицательные результаты, т.е. злокачественные клетки могут не выявляется, хотя доктор подозревает наличие опухоли. В этом случае через 6 месяцев процедура может выполняться повторно.
По способу выполнения выделяют три типа биопсии простаты: трансректальная, трансуретральная и трансперинеальная.
В зависимости от количества получаемых столбиков ткани биопсия простаты может быть:
- шеститочечная, – получение образцов ткани из шести точек предстательной железы.
- мультифокальная – забор 12-14 столбиков ткани железы.
- сатурационная – во время биопсии берется более 18 образцов ткани из различных точек предстательной железы.
При выполнении мультифокальной или сатурационной биопсии снижается вероятность получения ложно-отрицательных результатов исследования.
Показания к первичной биопсии:
- неоднократное выявление высокого уровня ПСА > 4 нг/мл.
- выявление уплотнений и узлов предстательной железы при проведении пальцевого ректального исследования.
- наличие гипоэхогенных очагов в простате, выявляемых при трансректальном ультразвуковом исследовании.
Показания для вторичной биопсии:
- недостаточное количество гистологического материала, полученного при первой биопсии.
- наличие клинических и биохимических признаков рака простаты, несмотря на отрицательные результаты первичной биопсии.
Подробнее про биопсию вы сможете узнать в статье “Биопсия простаты”.
К сказанному хотелось бы добавить, что мы никогда не руководствуемся одним лишь уровнем ПСА для определения показаний к проведению биопсии. “Подозрения” на опухоль предстательной железы должны формироваться из комплексных данных каждого мужчины. Безусловно само повышение ПСА начинает вызывать тревогу, ведь за этим должен последовать ответ – “есть ли у меня рак простаты?”. Данный ответ вы сможете получить обратившись к нам за консультацией.
Рак простаты — опасное для жизни заболевание: особенности диагностики и лечения

С одной стороны, по данным европейских информационных центров здравоохранения, рак простаты занимает первое место в структуре злокачественных новообразований у мужчин. С другой стороны, это одна из локализаций рака, когда при наличии клинически незначимого рака простаты, т.е. на начальных стадиях заболевания, пациенту не требуется лечение — достаточно только активного наблюдения.
Такое поведение врачей трудно понять пациентам, которые привыкли слышать, что рак нужно диагностировать лечить как можно раньше. Как правильно лечить больных раком простаты? Как выбрать, какие пациенты уже нуждаются в лечении, а какие нет?
О раке простаты много говорят. Поэтому болезнь все чаще диагностируется на ранней стадии и все больше пациентов излечиваются
В последние 10–15 лет в мире, и Европейских странах в частности, наблюдается тенденция к тому, что врачи все чаще выявляют случаи рака простаты на ранней стадии. Благодаря этому можно радикально вылечить 60–70% диагностированных случаев. Революцию в диагностике произвело открытие индикатора простатоспецифического антигена (ПСА).

Диагностика рака простаты на ранней стадии
Урологи удовлетворены этой тенденцией, поскольку теперь можно предложить пациентам широкий спектр эффективных методов лечения рака простаты гораздо раньше.
Однако есть еще одна проблема, связанная с ранней диагностикой рака простаты. Хорошо известно, что не каждый случай рака простаты требует лечения. Поэтому сегодня врачи вынуждены решать дилемму — как отличить, какого пациента нужно лечить, а какого достаточно просто наблюдать.
Другими словами, следует лечить только агрессивные, опасные для жизни формы рака простаты. Таким образом, диагностическая дилемма состоит не в раннем обнаружении рака простаты, а в том, чтобы выявить эту опасную форму болезни.
В отношении этой проблемы есть нерешенные вопросы, поскольку четких критериев, по которым врачи должны отбирать пациентов с агрессивной и опасной для жизни формой рака простаты до сих пор нет. Считается что должны помочь однозначно идентифицировать таких пациентов в ближайшем будущем биомаркеры. Урологи возлагают большие надежды на эти новые диагностические возможности.
Как генетические маркеры помогут отбирать пациентов и различать тех, кто нуждается в наблюдении, и тех, кого нужно лечить
Генных маркеров, которые мы могли бы применить на практике со 100% уверенностью (без подтверждения другими методами обследования) сегодня, нет хотя наука очень быстро движется к этому. Исследователи изучают BRCA2, PCA3, другие гены, но пока говорить об их пользе и значении в лечении рака простаты нельзя.
Ген PCA3 изучен достаточно широко, и он упоминается в рекомендациях, хотя этот генетический маркер по-прежнему больше используется в научных программах и лабораториях, чем в повседневной практике урологов. Последние данные показывают, что обнаружение гена PCA3, как ожидается, поможет именно на диагностической стадии для выявления пациентов с опасным распространенным раком.
Довольно часто урологи, выполняющие биопсию простаты, не видят раковых образований, хотя уровень ПСА выше допустимой отметки и растет. Благодаря современным диагностическим возможностям такой пациент остается в группе высокого риска рака простаты. С появлением тестирования гена PCA3 эти пациенты должны пройти дополнительное обследование, и экспрессия этого гена должна позволить определить, какие пациенты имеют гораздо более высокий риск развития агрессивного рака простаты в дополнение к вялотекущему раку простаты.
Обнаружение гена BRCA2 также может быть полезно, когда дело доходит до наследственного рака, рака простаты повышенного риска.
Оправдана ли программа ранней диагностики патологий предстательной железы, поскольку мнения о ней противоречивы
Критика программы раннего выявления рака простаты проистекает из того факта, что многим из них диагностируют клинически незначительный или клинически незначимый рак, который не требует лечения, но лечится. Между тем лечение — операция или лучевая терапия — стоит дорого.
Что делать, если человек так же долго проживет без радикального лечения? По словам урологов, почти половину всех вновь диагностированных случаев рака предстательной железы I или II стадии можно было только активно контролировать в течение 5 или 10 лет без какого-либо лечения.
Активный мониторинг означает, что пациенту следует чаще проводить анализ ПСА (каждые 3 или 6 месяцев) и биопсию простаты каждые 2-3 года. Да около 60-70% наблюдаемых пациентов могут избегать радикального лечения. Другими словами, эти люди будут жить счастливо и умирать вовсе не от рака простаты, а от сердечного приступа, инсульта и т.п.

Биопсия простаты
Инновации в диагностике: позитронно-эмиссионая томография (ПЭТ)
Пока что врачи не используют ПЭТ-тест для диагностики рака простаты на практике, хотя на него также возлагаются большие надежды. В этом анализе и с использованием различных реагентов делается попытка определить наличие метастазов в регионарных лимфатических узлах. Также были проведены исследования, которые показали некоторую чувствительность и специфичность к этому исследованию, но пока в свободном и доступном арсенале простых врачей его нет.
Какая стадия рака простаты лечится наиболее эффективно, какие методы или методы лечения используются?
Для лечения начальных стадий рака простаты может быть предложено наблюдение или 2 формы радикального лечения:
Если у пациента диагностирован рак простаты на поздней стадии, ему назначают гормональную терапию, чтобы продлить жизнь, но полностью вылечить пациента уже невозможно. Конечно, на ранних стадиях рака шансы на выздоровление самые высокие.
Эффективное лечение распространенного рака простаты — новейшие методы лечения рака простаты на поздних стадиях
Стандартным лечением прогрессирующего рака простаты с метастазами является терапия андрогенной депривации, цель которой остановить секрецию естественного тестостерона в яичках. Это лечение используется в европейской урологической практике 30-40 лет, и врачи, которые предлагали эту терапию, получили Нобелевскую премию за лечение рака простаты антигормонами.
За это время наука значительно продвинулась вперед, и теперь появляются новые группы препаратов, которые все еще поддерживают механизм гормональных эффектов. В настоящее время наиболее близким к клинической практике является абиратерона ацетат. Его можно использовать для лечения в гормональной терапии или резистентного рака простаты, когда болезнь прогрессирует даже после химиотерапии.

Гормональная терапия для лечения рака простаты на поздних стадиях
Таким образом, пациенты с тяжелыми формами рака надеются на более эффективное лечение, поскольку им помогают несколько совершенно новых классов лекарств с различными механизмами действия. Это антиандрогены нового поколения. Препараты с подобным действием тоже находятся в стадии клинических исследований, например, много говорится про энзалутамид.
Как непрофильные врачи могут способствовать лечению этого заболевания
Врачи общей практики должны быть осведомлены о положениях программы ранней диагностики рака простаты, поскольку именно они должны познакомить с ней пациентов, направить их к урологу, который назначит сдать тест на ПСА.
Терапевты могут первыми заметить, что состояние пациента ухудшилось, возникла боль в костях или прогрессирует почечная недостаточность, и в этом случае они должны немедленно направить на консультацию к урологу для корректировки лечения.
Методики лечения рака простаты, рекомендуемые европейским и американским руководством для урологов
Многие урологи используют Европейское руководство по лечению рака простаты. Самая важная новость — это внедрение в лечение антиандрогенов нового поколения — абиратерона ацетата, энзалутамида, ипилимумаба и других. В США и Европе в повседневную практику включены кабазитаксел и альфарадин.
Еще одна новость заключается в том, что в США успешно протестирована вакцина для лечения распространенного рака простаты, когда метастазы в кости уже присутствуют. Это особая технология, которая позволяет врачам создавать индивидуальную вакцину для конкретного пациента и его формы заболевания, которая достаточно эффективна для остановки прогрессирования болезни.
Для лечения метастазов в костях разработан новый препарат — деносумаб. Есть новости о лекарствах для лечения рака простаты. Все это открывает большие перспективы для врачей, поскольку они расширяют возможности по борьбе с раком простаты, и для пациентов, поскольку они позволяют даже тем, у кого тяжелые формы рака простаты, жить дольше и лучше.
Профилактика развития рака простаты
К сожалению, причины рака простаты еще до конца не выяснены, поэтому об эффективной профилактике говорить не приходится. Очевидно, что некоторые факторы риска известны.
- Основные факторы риска в онкологии — курение, вредные факторы окружающей среды и др.
- На развитие болезни влияет возраст. К сожалению, мы не остановим биологические часы.
- Еще один фактор риска — расовая принадлежность. Афроамериканцы подвержены более высокому риску рака простаты. Мы тоже не можем выбирать расу.
- Еще один фактор риска — наследственность. Хорошо известно, что мужчины, чьи дедушки или родители болели раком простаты, особенно если они умерли от этого заболевания, имеют в 5-8 раз больше шансов заболеть раком простаты, чем те, у кого не было такого родственника. Впрочем, на наследственность мы тоже не влияем.
Таким образом, факторы риска известны, но большинство из них нельзя изменить.
Одна из профилактических мер — это ранняя диагностика рака простаты. Однако, здесь возникает другая проблема: вместо активного наблюдения за пациентом врачи, выявив незначительный рак простаты, с которым человек может жить довольно долго, начинают лечить его, когда в этом нет необходимости. С другой стороны, пациент эмоционально пытается справиться с сообщением о том, что у него рак простаты, но лечение пока не требуется.
Что касается продуктов, которые могут повлиять на рак простаты, научно доказанных данных об их вреде или пользе по факту нет. К сожалению, ни селеносодержащие продукты, ни зеленый чай, ни помидоры не продемонстрировали свою эффективность в снижении риска рака простаты.
Вы можете записаться по бесплатному номеру телефона 8-800-707-15-60 или заполнить контактную форму. В этом случае мы свяжемся с вами сами.
Рак предстательной железы: почему возникает, симптоматика, методы диагностики и лечения
Согласно данным множества исследований, отмечается неуклонный рост случаев обнаружения первичного рака предстательной железы (РПЖ). В России это заболевание находится на 4-м месте среди всей онкологии, выявляемой во время профосмотров. Опережает его рак шейки матки, молочной железы и губы. В западных странах рак простаты составляет 25% от всех онкологических заболеваний.
Что такое рак простаты?
РПЖ представляет собой злокачественное новообразование, которое развивается из тканей предстательной железы.
Предстательная железа, или простата, – мужской репродуктивный орган, по размерам схожий с каштаном. Он находится под мочевым пузырем и охватывает передний отдел мочеиспускательного канала.
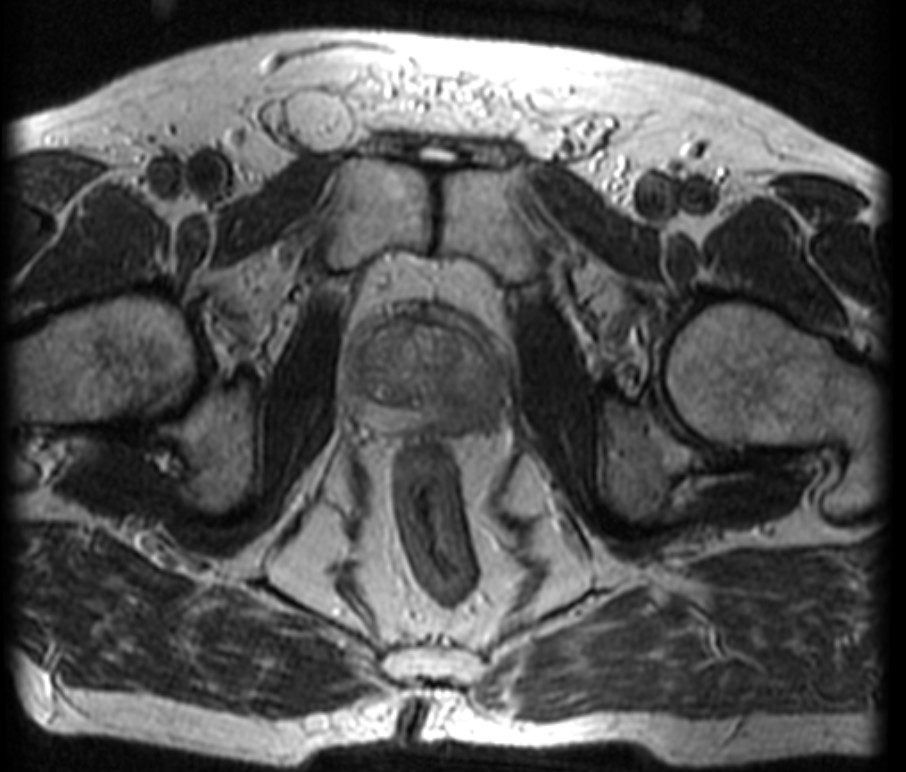
Рис. 1. МРТ (Т2-взвешенные изображения) картина поражения левой доли предстательной железы.
Разновидности рака предстательной железы
В 95% случаев РПЖ развивается из эпителиальных клеток собственных желез (их называют «ацинусы»), из которых сформирована периферическая часть предстательной железы. Эта форма болезни называется «ацинарная аденокарцинома». В остальных 5% случаев диагностируется интрдуктальная разновидность, для которой характерно более агрессивное течение.
Важная характеристика аденокарциномы – степень ее дифференцировки, которая выявляется при гистологическом исследовании биоптата или биоматериала, полученного в ходе операции. Дифференцировка сегодня выражается шкалой Глисона (Gleason), в соответствии с которой присваивается сумма баллов: от 6 (самый благоприятный прогноз) до 10 (самый неблагоприятный вариант).
Характерные признаки заболевания
Риск развития РПЖ растет с возрастом: средний показатель в этой категории заболевших – 68 лет. Существуют также факторы риска, то есть то, что повышает шанс появления онкологического заболевания. Современной медициной не выявлены достоверные факторы, которые приводят к повышению риска развития РПЖ (какие-либо препараты, характер рациона, вредные привычки, плохая экология и др.). Поэтому основным фактором остается возраста, а также возрастной гормональный дисбаланс (между эстрогенами и андрогенами).
Симптоматика, первые признаки
На ранних стадиях злокачественная опухоль обычно не проявляет себя. Кроме аденокарциномы, у людей с повышенным риском развития РПЖ почти всегда присутствуют сопутствующие патологии (простатит, аденома простаты), и они могут давать симптоматику. Чаще всего встречаются следующие симптомы:
- частое мочеиспускание, включая ноктурию (то есть учащение позывов в ночное время);
- трудности при мочеиспускании;
- ощущение, что мочевой пузырь опорожнен не полностью;
- боль при мочеиспускании;
- гематурия, то есть кровяные включения в моче;
- гемоспермия – при эякуляции наличие примесей крови в сперме;
- костные боли, появляющиеся при метастазировании РПЖ в скелет.
Таким образом, чем выше стадия, тем больше вероятность проявления симптоматики. Чаще всего РПЖ обнаруживается во время профилактического обследования (оно рекомендовано всем мужчинам старше 40-ка лет). Такое обследование включает в себя:
-
;
- пальцевое ректальное исследование;
- определение ПСА (простат-специфического антигена).
ПСА – это маркер, используемый для раннего выявления РПЖ. Он достаточно чувствителен и специфичен, чтобы заподозрить наличие рака на начальной стадии. Кроме ПСА, анализу могут подвергаться его производные – индекс здоровья простаты, плотность ПСА, соотношение свободного ПСА и общего.
Методы диагностики
Основа диагностики РПЖ – биопсия предстательной железы, иными словами, морфологическая верификация.
Показания к биопсии:
- Уровень ПСА выше нормального. Следует отметить, что верхняя граница нормы (4 нг/мл) может быть понижена для относительно молодых мужчин (возраст 40-50 лет) до 2-2,5 нг/мл.
- Подозрительные изменения очагового характера (гипоэхогенные очаги), выявленные при УЗИ (или ТРУЗИ) либо МРТ. Сейчас рекомендуется делать биопсию после МРТ, а не до нее, потому что это улучшает толкование изменений. Важно: делать МРТ лучше в специализированном учреждении, специалисты которого имеют нужный опыт, а диагностическое оборудование – специализированное ПО (то есть мультипараметрическая МРТ).
- Обнаруженные в ходе пальцевого исследования очаговые изменения.
Важно! Если уровень ПСА ниже верхней допустимой границы, это не всегда говорит о том, что РПЖ отсутствует. Примерно 25% случаев заболеваемости отмечаются на фоне нормальных значений этого показателя. Поэтому решение о необходимости проведения биопсии должно приниматься после комплексного обследования, которое включает все виды диагностики.
Варианты биопсии простаты:
- Стандартная, или трансректальная мультифокальная. Такая биопсия делается обычно амбулаторно. Выполняется через прямую кишку, в ходе процедуры берут не менее 6-ти биоптатов (лучше 10-12). Недостаток этого вида биопсии – вероятность пропустить РПЖ, если он имеет малые размеры и локализуется в определенных зонах предстательной железы.
- Промежностная. Проводится обычно по расширенной методике (сатурационная процедура). В ходе нее беру гораздо больше биоптатов – от 20-ти. Такая биопсия показана тем, кому проводились стандартные биопсии, но они не выявили РПЖ, при этом риск развития заболевания сохраняется. Еще одно показание: планирование органосохраняющего лечения (фокальная терапия, брахитерапия). Недостатки методики – необходимость обеспечения пациенту спинальной анестезии, использования специализированного оборудования, стационарные условия проведения. Однако именно такая биопсия дает возможность наиболее точно выявить характер патологических изменений.
- Fusion. Это современная разновидность биопсии предстательной железы, при которой используется современное оборудование и данные МРТ, проведенной заблаговременно. Широкое применение такой методики сейчас ограничено ввиду отсутствия в лечебных учреждениях нужного оборудования.
Рис. 2 А., 2 Б. Фьюжн-биопсия. Мастер-класс в НМИЦ онкологии им. Н.Н. Петрова
Стадии рака предстательной железы
Стадирование РПЖ и определение группы риска рецидивирования после возможной терапии производятся после гистологической верификации заболевания.
Стадирование при стандартном подходе подразумевает остеосцинтиграфию и МРТ органов малого таза. Магнитно-резонансная томография нужна, чтобы выявить степень локального распространения процесса в зоне простаты (прорастание в семенные пузырьки, выход новообразования за капсулу железы), а также определить, есть ли поражение регионарных лимфоузлов.
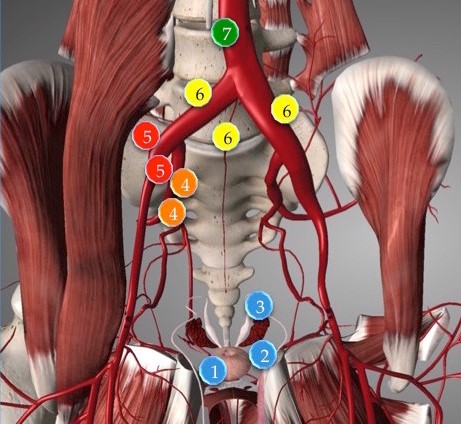
Рис. 3. Пути распространения рака предстательной железы в лимфоузлы таза.
В случае необходимости дополнительно проводится КТ органов груди или брюшной полости.
Цель проведения остеосцинтиграфии – выявление возможного поражения опухолью костей скелета.
Могут назначиться дополнительные исследования – рентгенография (прицельная), УЗИ, урофлоуметрия.
Группа риска определяется, исходя из уровня ПСА на момент до начала терапии, суммы Глисона, согласно данным биопсии, и клинической стадии болезни. Группа риска может быть низкой, промежуточной и высокой. Ее определение крайне важно, чтобы выбрать оптимальный метод лечения.
ПСА от 10 до 20 нг/мл
ПСА более 20 нг/мл
сумма Глисона 6
сумма Глисона 7
сумма Глисона 8-10
Методики лечения
В соответствии с результатами многоцентрового проспективного рандомизированного исследования ProtecT (2016) лучевая терапия и хирургическое лечения демонстрируют раную противоопухолевую эффективность и обеспечивают надежный контроль над заболеванием у большинства (более 90%) больных раком предстательной железы с низким и промежуточным риском рецидива заболевания. В настоящее время решающим фактором при выборе противоопухолевого лечения у этой категории больных является безопасность терапии и снижение риска осложнений.
Рассмотрим основные виды терапии: хирургическое лечение, брахитерапия, стереотаксическое облучение, сочетанная лучевая терапия.
Хирургическое вмешательство
РПЭ, или радикальная простатэктомия, представляет собой хирургическое вмешательство по удалению предстательной железы, а также окружающей клетчатки и лимфоузлов. При такой операции с железой единым блоком удаляют семенные пузырьки и участок канала уретры.
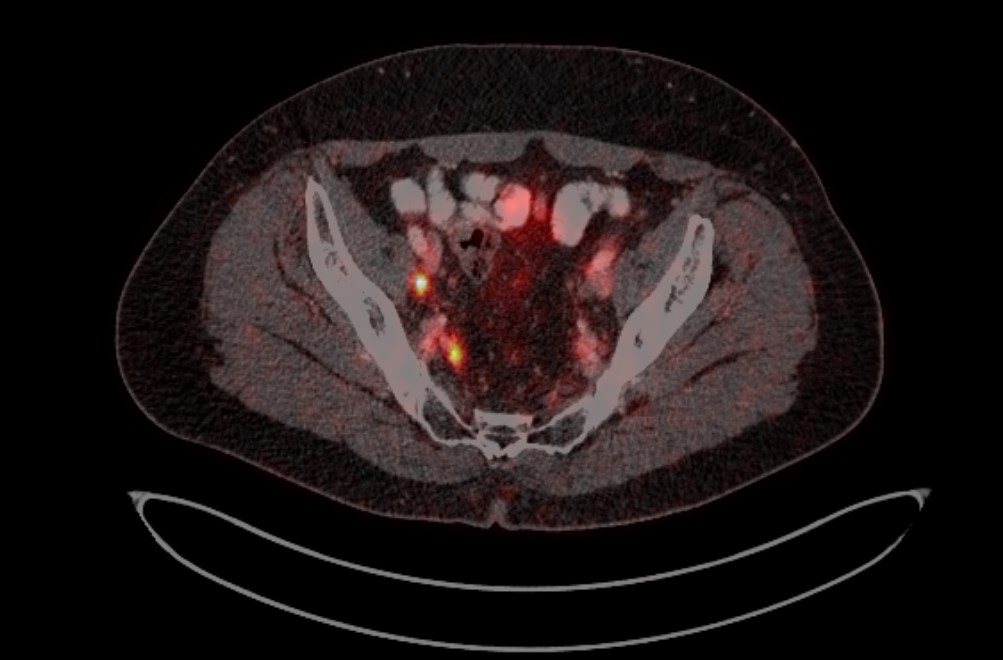
Рис. 4. ПЭТ-КТ изображения больного М. с поражением тазовых лимфоузлов
РПЭ различается по виду доступа и степени инвазивности:
- Открытая. Проводится двумя основными видами доступа: промежностным и позадилонным.
Позадилонный доступ предполагает разрез в нижней части живота, через который удаляется простата и местные ткани.
Промежностная методика – это открытый способ, при котором небольшой надрез делается в зоне между анусом и кожно-мышечным мешком, то есть мошонкой. Методика позволяет удалить простату, но при ее применении нельзя также удалить неблагоприятные ткани и узлы, расположенные около железы. Если после проведения промежностной операции в органах малого таза обнаружатся раковые клетки, нужно будет дополнительно делать лимфаденэктомию. Сейчас промежностная методика применяется крайне редко.
- Лапароскопическая. Основные доступы: через предбрюшинное пространство или брюшную полость. Для выполнения операции делается несколько небольших разрезов на передней стенке живота. Через них в предбрюшинное пространство или брюшную полость вводят специальные манипуляторы и удаляют предстательную железу, жировую клетчатку малого таза, а также регионарные лимфатические узлы.
Лапароскопическая методика – наиболее щадящая. Врач имеет доступ к пораженному органу через маленький разрез внизу живота. В него вводится камера и все нужные хирургу инструменты. Камера подает на экран изображение органов малого таза, благодаря чему врач полностью контролирует процесс, а пациент получает минимум вреда. При таком способе минимизированы кровопотери, посторонние органы почти не травмируются, эректильная функция сохраняется частично или полностью и т. д.
Рассмотрим также наиболее распространенные осложнения, которые могут возникнуть после операции на простате:
- Недержание мочи. Это осложнение возникает в 95% случаев сразу после снятия с мочевого пузыря пациента специального катетера. Далее в 45% случаев это осложнение проходит через 6 месяцев после удаления РПЖ. В 15% случаев недержание сохраняется до 1 года.
- Потеря эректильной функции – полная или частичная. Существенно снизить такое осложнение врачам удается при проведении лапароскопической простатэктомии. При такой методике минимизировано повреждение нервных стволовых клеток органов малого таза. Если после хирургического вмешательства наблюдается расстройство эректильной функции, то пациенту прописывается курс медикаментозной терапии и наружных препаратов, расширяющих сосуды.
Брахитерапия
Брахитерапия представляет собой введение в ткани источников излучения. Эта методика – самая «молодая» среди способов лечения РПЖ. Сегодня это один из наиболее востребованных методов облучения простаты, обеспечивающий очень высокую избирательность подведения дозы. Основная особенность брахитерапии заключается в том, что простата облучается изнутри – источник облучения вводится непосредственно в нее. Такой метод дает возможность применять высокие дозы (100-140 Гр и более), при этом избегая высокого риска лучевого поражения не подверженных раку тканей.
Стремительный рост клинического применении брахитерапии, по сравнению с хирургическими вмешательствами, обуславливается высокой эффективностью, которая сопоставима с простатэктомией, при гораздо более низкой частоте возникновения осложнений.
Различают 2 вида брахитерапии, в зависимости от способа введения источника излучения в железу и его мощности:
- высокомощная, для которой характерно кратковременное введение источника излучения высокой мощности в ткани;
- низкомощная – источник низкой мощности устанавливается на все время лечения.
При проведении низкомощностной брахитерапии в ткани простаты вживляется источник излучения и остается в них до полного распада. Долгое время при РПЖ именно этот вид брахитерапии применялся чаще всего. Наиболее часто для выполнения терапии используется изотоп радиоактивного йода, то есть I125.
Согласно многочисленным исследованиям, брахитерапия низкой мощности обеспечивает не очень высокую точность облучения. Это объясняется смещением источника излучения, изменением формы и размеров простаты, затрагиванием прилежащих здоровых органов. Ввиду этого низкомощностная методика показана в основном пациентам с самыми начальными стадиями, когда опухоль небольшая и не выходит за пределы железы. Такая брахитерапия имеет и другие существенные недостатки. Первый – это высокая частота осложнений, возникающих со стороны мочевыводящих путей, может даже возникнуть острая задержка мочи и необходимость эпицистостомы, то есть формирования надлобкового мочепузырного свища, на долгий срок. В основе осложнений – отек предстательной железы из-за того, что в ней остается несколько сотен зерен (инородных тел). Кроме того, радиоактивные зерна, если они долго находятся в организме, представляют собой источники излучения, представляющие определенную опасность для других людей. Из-за этого контакт пациента с родными ограничен (нельзя близко общаться с маленькими детьми).
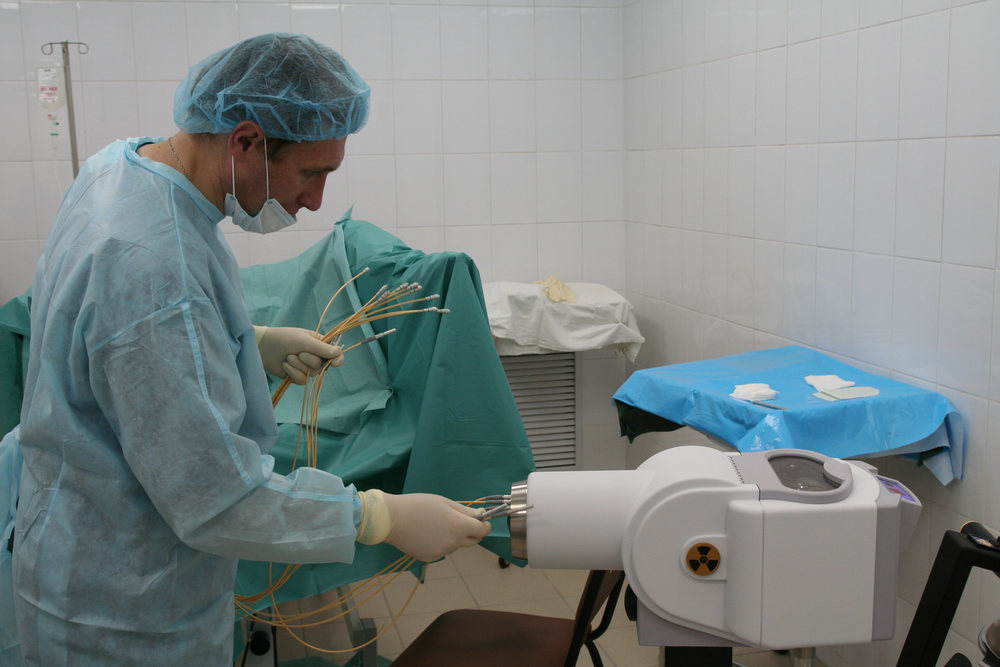
Рис. 5. Высокомощностная (высокодозная) брахитерапия
Самая современная методика внутритканевой терапии – высокомощностная брахитерапия. Источники излучения автоматически загружаются и извлекаются. Эта лучевая терапия обладает принципиальным плюсов – высокой точностью облучения, достигаемой путем введения игл под контролем специального УЗ-аппарата. Одновременно в автоматическом режиме рассчитываются дозы и возможность быстрой корректировки плана лучевого лечения. Источник излучения находится в организме пациента временно, поэтому уровень осложнений – самый низкий, по сравнению со всеми радикальными методиками терапии РПЖ, включая низкодозную разновидность брахитерапии.
Технологические особенности методики позволяют предлагать ее большинству больных, вне зависимости от размеров злокачественного новообразования и его распространенности за пределы простаты. Кроме того, высокомощностная брахитерапия – это «золотой стандарт» при комбинированном лечении, то есть одновременном использовании с дистанционным облучением у больных с неблагоприятными характеристиками новообразования.
Самый большой недостаток высокомощностной методики – высокие требования, касающиеся квалификации медицинского персонала, а также необходимость использования высокотехнологичного оборудования. Этим объясняется малая распространенность метода в России.
Противопоказания к брахитерапии подразделяются на общие и урологические. Самые частые урологические противопоказания – это серьезные нарушения процесса мочеиспускания:
- IPSS (индекс опросника качества мочеиспускания) более 20-ти;
- объем остаточной мочи более 50-ти мл;
- самая высокая скорость мочеиспускания, зарегистрированная при урофлоуметрии, – до 10 мл/сек;
- проведенная трансуретральная резекция мягких тканей предстательной железы менее чем за 9 месяцев до предполагаемой брахитерапии.
Нужно отметить, что большой объем простаты, который имеет значение для низкодозной брахитерапии (50-60 см 3 ), почти не ограничивает возможности лечения в режиме высокомощностной методики.
- отдаленные метастазы;
- злокачественные опухоли, инфекции и воспаления мочевого пузыря;
- злокачественные опухоли, инфекции и воспаления прямой кишки;
- непереносимость анестезии;
- отсутствие прямой кишки ввиду предшествующих операций.
Данные противопоказания относятся не только к брахитерапии, но и к другим методикам лучевой терапии РПЖ.
Стереотаксическое облучение
СТЛТ (стереотаксическая лучевая терапия) – высокоточная методика лечения очага РПЖ высокими дозами ионизирующего излучения.
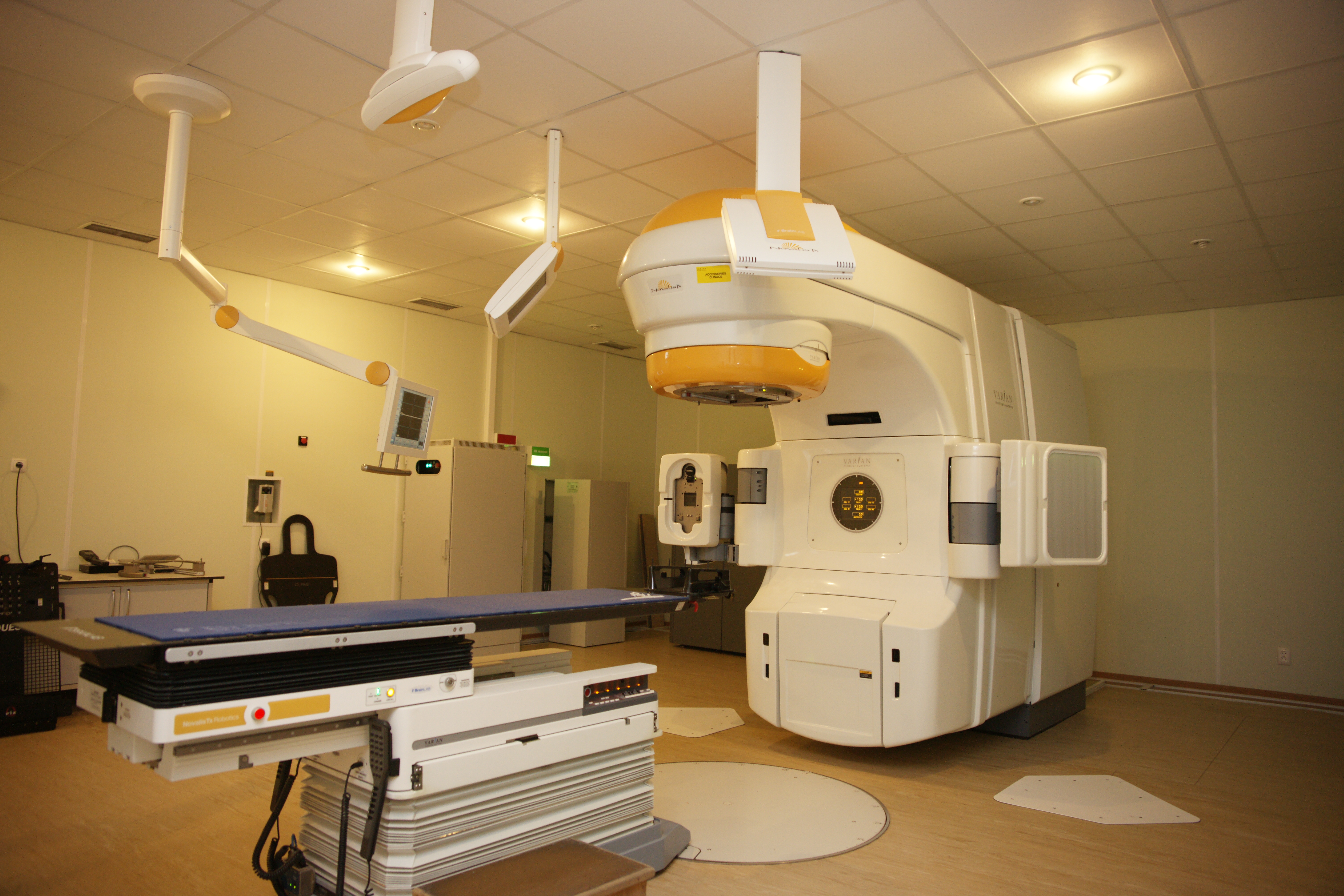
Рис. 6. Стереотаксический лучевой ускоритель
Сегодня СТЛТ при раке простаты реализуется несколькими основными методами, каждый из которых обладает своими особенностями, плюсами и минусами:

.png)