Что такое ХМЛ и как с ним бороться
Михаил Фоминых — научный сотрудник Российского НИИ гематологии и трансфузиологии, Санкт-Петербург. Практикующий онкогематолог, который посвятил свою научную деятельность хроническому миелолейкозу, и в 2016 году защитил на эту тему диссертацию. В ходе дискуссии он раскрыл основные симптомы ХМЛ, рассказал про зоны риска и ограничения, а также объяснил, можно ли родить здорового ребенка с таким диагнозом.
Каковы основные симптомы ХМЛ?
Зачастую самого человека ничего особо не беспокоит. Очень часто пациент попадает к нам от другого специалиста: терапевта или хирурга. Люди сдают плановые анализы и выясняется, что у них повышенное количество белых кровяных телец. Обнаружив повышенные лейкоциты, терапевт или хирург направляет пациента к гематологу.
Если говорить о симптоматике, то это может быть повышенная усталость, потливость, немотивированные подъемы температуры тела до 38 без явных признаков инфекции, тяжесть в левом подреберье за счет того, что селезенка увеличивается в размере. Если следить за здоровьем и каждый год сдавать анализы, то хронический миелоидный лейкоз можно выявить на ранней стадии. На сегодняшний день 95% случаев ХМЛ диагностируется в хронической фазе и только 5% — в запущенных, продвинутых. Это фазы акселерации и бластного криза, когда начинают проявляться симптомы опухолевой интоксикации.
Самый яркий симптом ранней стадии ХМЛ — немотивированная потеря массы тела в течение полугода. Если вы не сидите на диете и не работаете над снижением веса, но теряете килограммы, а помимо этого наблюдается повышенная потливость и температура выше 38 — это повод насторожиться и пойти сдать анализы.
ХМЛ в «продвинутой» стадии проявляется слабостью и повышенной утомляемостью вследствие анемии, может появляться повышенная кровоточивость из десен или из носа, появление синяков. В принципе, эти симптомы характерны для всех гематологических болезней, которые связаны с поражением костного мозга.
Насколько должны быть повышены лейкоциты, чтобы заподозрить ХМЛ?
На сегодняшний день норма лейкоцитов составляет от 4 до 9 на десять в девятой степени в литре. Но нужно понимать, что эти цифры зависят от многих факторов: перенесенная инфекция, операция. Только по количеству лейкоцитов никто не скажет, что у вас лейкоз — в любом случае необходимо будет провести дополнительное обследование. Если повышенный лейкоцитоз 10-11 проявляется однократно — это еще не повод бежать к гематологу, так как это может быть вполне нормальная реакция организма на перенесенную вирусную или бактериальную инфекцию. Но если в течение трех месяцев наблюдается лейкоцитоз выше 15, то это повод обратиться к гематологу. Мы рекомендуем наблюдать за показателями крови и сдавать анализы хотя бы раз в год, чтобы вовремя выявить сбой и начать лечение, если оно необходимо.
Можно ли говорить о том, что кто-то находится в зоне риска? Есть ли предрасположенность? Влияет ли экология?
Наследственность здесь не играет абсолютно никакой роли. Если у родителей был ХМЛ, то далеко не факт, что он будет у детей: наследственная теория пока не нашла подтверждения. То же самое касается всех остальных существующих теорий: вирусной, бактериальной.
Не так давно произошла ужасная история, когда больных лейкозом детей выселяли из квартир, потому что жители дома считали, будто рак может передаваться воздушно-капельным путем. Это, разумеется, не так: онкологические заболевания не передаются таким способом. Если бы онкологические болезни передавались воздушно-капельным путем, то я и другие врачи-онкологи уже, наверное, поумирали бы: своего первого онкологического пациента я увидел на третьем курсе, за 15 лет практики я повидал их тысячи и пока, к счастью, жив, здоров и не имею никакого онкологического диагноза.
После получения ионизирующего излучения риск действительно повышается: после Чернобыля, Хиросимы и Нагасаки отмечался всплеск развития острых лейкозов. Это подтвержденный факт, но наследственность на возникновение лейкозов никаким образом не влияет. Другие теории пока тоже не нашли подтверждения. Врачи, к сожалению, пока не выявили причину.
Можно сказать, что ХМЛ — это несчастный случай, как кирпич на голову?
Да, это именно так. Я сейчас сижу перед вами, а вы сидите за своими гаджетами, и внутри каждого организма прямо в это время происходит энное количество мутаций. Это случается, пока мы спим, едим, идем по улице. Пока наша иммунная система справляется с возникающими мутациями, все хорошо. Когда возникает сбой и система перестает справляться, начинает развиваться опухолевый процесс. В случае с гематологическими болезнями, для этого достаточно мутации одной клетки. И это действительно, как кирпич на голову. Хронический лейкоз возникает спонтанно, мы не можем его спрогнозировать.
Как строится лечение при ХМЛ?
В первой линии терапии назначается Иматиниб. Если до 1999-го года после постановки диагноза пациенты проживали 3-4 года, то сегодня можно говорить о 20-летней выживаемости. Пациенты с ХМЛ продолжают жить полноценной спокойной жизнью и умирают также, как их сверстники от сердечно-сосудистых заболеваний, сахарного диабета и так далее. Лечение Иматинибом происходит амбулаторно. Пациент получает препарат в аптеке, принимает дома и живет, в общем, как совершенно обычный человек. Помимо Иматиниба, существуют препараты второго и третьего поколения. И даже уже четвертого, они пока проходят клинические исследования.
Можно ли беременеть при ХМЛ?
При лечении новыми препаратами, которые проходят клинические исследования, необходимо применять контрацептивы, потому что мы пока не знаем, как эти новые лекарства могут повлиять на плод. В случае с уже хорошо известными, необходимо принимать решение совместно с лечащим врачом, гематологом и гинекологом, ведущим беременность. Например, у Екатерины Юрьевны Челышевой, которая работает в НМИЦ гематологии, огромный опыт и большой регистр пациенток с хроническим миелолейкозом, которые забеременели и родили здоровых детишек. Если ситуация позволяет безопасно отменить терапию на время зачатия и хотя бы первый триместр, необходим ежемесячный мониторинг. Если мы видим, что молекулярный ответ потерян, то по жизненно важным показаниям терапию придется вернуть.
Полная отмена происходит, к сожалению, не так быстро, как нам хотелось бы. В случае с ингибиторами тирозинкиназы первого поколения – чуть дольше. Со вторым поколением – чуть раньше: примерно от трех до пяти лет постоянного приема. Достигаем молекулярного ответа, отменяем терапию, и там — пожалуйста. Снимаем ограничения в плане беременности и вообще, в принципе, большинство ограничений. Это обычный выздоровевший человек, излеченный от онкологического заболевания. Беременеть – можно. Единственное, что требуется — постоянный мониторинг со стороны именно гематолога.
Лечение препаратами второго и последующих поколений позволяют сохранить репродуктивные функции, хотя раньше это казалось нонсенсом. Сейчас даже в рекомендациях по лечению онкологических заболеваний рекомендовано обсудить с пациентами их репродуктивные планы, и только после этого назначать препарат. Сегодня существуют препараты, которые не так сильно влияют на фертильность, и у женщины остается возможность забеременеть и выносить здорового ребенка. Сейчас сохранение репродуктивных функций является нормой и одной из целей при лечении больных с ХМЛ. Это ли не счастье?
Есть ли какие-то ограничения, которые накладывает ХМЛ или их нет? Какова жизнь при ХМЛ и после ХМЛ, если мы добиваемся полной ремиссии и прекращаем лечение препаратами?
Я так радужно говорю о том, что все победили, все выиграли, но чтобы этого добиться, необходимо тесное сотрудничество между лечащим врачом и самим пациентом. Какие-либо изменения в жизни необходимо обсуждать с лечащим врачом, нельзя принимать решения самостоятельно — только после консультации с лечащим врачом.
Единственное строгое ограничение, которое действительно существует, — это употребление грейпфрутового сока. Это категорически запрещено. Если упростить, грейпфрутовой сок влияет на усваиваемость препаратов с ингибиторами тирозинкиназы, и они становятся неэффективными: то есть, ты принимаешь лекарство, а оно не действует так, как должно. Также существует ряд препаратов, которые могут усиливать эффект препаратов или снижать его, поэтому перед началом лечения у гематолога необходимо сообщить о всех лекарствах, которые вы принимаете постоянно. Если длительность приема препаратов не превышает неделю, то это ни на что не влияет, но если терапию назначают на постоянной основе, то может возникнуть конфликт. Особенно это касается гипотензивных препаратов для нормализации давления.
Если говорить о спорте, то можно постепенно возвращаться к нему после того, как всё — размеры селезенки, анализ крови, общее самочувствие — нормализуется. Умеренные физические нагрузки — это пожалуйста. Наши коллеги из США недавно провели исследования, которые доказали, что занятия йогой, дыхательные упражнения, цигун позитивно сказываются на качестве жизни пациентов с миелопролиферативными заболеваниями.
Можно ли ездить на море, проходить санаторно-курортное лечение?
Этот вопрос до конца неясен. Раньше каждый онкологический диагноз ставил крест на любой физиотерапии, любом санаторно-курортном лечении. Сейчас единственное, что я запрещаю всем, и не только своим пациентам, но и здоровым здоровым людям – избегать повышенного излучения солнечных лучей. В море купайтесь, сколько влезет, но от солнца следует закрываться. И мы сейчас говорим не только о тех, кто находится в ремиссии, но и о тех, кто находится на лечении, принимает медикаменты. Если чувствуете себя хорошо, анализ крови нормальный, то море — пожалуйста. Но вот активного солнца следует избегать — это пагубно сказывается на всех без исключения. Повышенное воздействие солнечных лучей, ультрафиолета повышает риск развития меланомы. Это доказано.
Можно ли полностью вылечить ХМЛ?
Хронический миелолейкоз — это заболевание, с которым можно жить, и мы этому учим. Существуют школы для диабетиков, школы для больных с артериальной гипертензией, а мы теперь проводим школы для больных с хроническим миелолейкозом: читаем лекции, консультируем больных, образовываем, чтобы они знали про болезнь больше, чем мы. При ХМЛ необходимо мониторить свое состояние и раз в полгода сдавать контрольные анализы. Сейчас проводятся общемировые исследования по поводу возможности полной отмены терапии. Примерно половине пациентов терапию отменяют. В другой половине случаев в течение первого полугода, к сожалению, приходится вернуться к терапии, потому что возникает рецидив. Все очень индивидуально.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – это поражение костного мозга, из-за которого измененные белые кровяные клетки размножаются слишком быстро.
Заболевание, которое обыватели называют «раком крови», может возникнуть у людей любого пола и возраста, но чаще всего встречается у мужчин от 65 лет и старше.
Как развивается острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) начинается в костном мозге – мягкой внутренней части костей, состоящей из жировых и кроветворных клеток, включая стволовые, которые становятся:
- лимфоцитами, основной задачей которых является борьба с инфекциями и повреждением тканей;
- либо миелоидными клетками, способными превращаться в: белые и красные кровяные тельца, переносящие кислород из легких в другие ткани, а также тромбоциты, необходимые для остановки кровотечений – они помогают закрывать отверстия в сосудах, возникающие при порезах или ушибах.
Лейкоз начинается с изменения ДНК – содержащейся в каждой клетке нашего тела молекулы, в которой зашифрована вся информация об организме. Такие «поломки» возникают из-за воздействия химикатов, радиации, различных заболеваний или случайных сбоев, и приводят к производству слишком большого количества бластов – быстро растущих незрелых, то есть не работающих белых кровяных телец.
Нормальные бласты со временем превращаются в полезные клетки крови, а при лейкозе они становятся опухолевыми, активно размножаются и постепенно вытесняют нормальные, что приводит к ряду тяжелых последствий. У здорового человека их не много – они составляют 5% или меньше от костного мозга, а в крови не обнаруживаются. Для того, чтобы врач поставил диагноз «острый миелоидный лейкоз», их должно быть не менее 20%.
Такие клетки не просто циркулируют по организму – они распространяются в различные органы, включая лимфатические узлы, печень, селезенку, яички, головной и спинной мозг, скапливаются и повреждают их.
Врачи выделяют две основных формы миелоидного лейкоза:
– острый – развивающийся внезапно и быстро;
– и хронический – при данном типе заболевания бласты вытесняют здоровые клетки крови гораздо медленнее, чем при остром.
Причины возникновения острого миелоидного лейкоза
Точные причины развития данного заболевания врачам до сих пор не известны – они знают лишь о факторах, которые могут спровоцировать его возникновение:
- Возраст: острый миелоидный лейкоз возникает и у детей, и у взрослых, но чаще всего он обнаруживается у пожилых людей, а средний возраст постановки диагноза составляет около 68 лет.
- Курение – единственный доказанный фактор риска, связанный с образом жизни. Вредная привычка способна вызвать не только рак легких, рта или горла, поскольку ядовитый дым влияет и на клетки, которые не вступают с ним в прямой контакт. Содержащиеся в нем вещества поглощаются дыхательными путями и с кровью распространяются в различные части тела, в том числе в костный мозг.
- Химикаты: с развитием лейкоза связывают длительное воздействие бензола – растворителя, который используется в резиновой и автомобильной промышленности, а также на нефтеперерабатывающих заводах. Он содержится в бензине, сигаретном дыме, выхлопных газах машин, некоторых клеях, чистящих средствах и красках.
- Радиация: ее воздействие, в том числе полученное при лучевой терапии рака, увеличивает вероятность возникновения ОМЛ.
- Заболевания крови также относят к факторам риска, способным спровоцировать острый миелоидный лейкоз.
- Пол: взрослым мужчинам данный диагноз ставится чаще, чем женщинам, при этом среди юных пациентов мальчиков примерно столько же, сколько девочек. Причины такой статистики ученым до сих пор не известны.
- Генетические нарушения. Шанс образования ОМЛ повышен у обладателей различных генетических нарушений и особенностей, включая синдром Дауна Синдром Дауна – это генетическое нарушение, вызывающее умственную отсталость, задержку развития, пороки сердца и множество других проблем со здоровьем. У людей с данной особенностью развития есть не 46 хромосом, а на одну больше – 47. и трисомию 8 Трисомия 8 – это генетическое нарушение развития, у обладателей которого есть не две копии восьмой хромосомы, а целых три. .
- Лечение: заболевание чаще развивается у онкологических пациентов, которые получают определенные химиотерапевтические препараты. К ним относятся циклофосфамид, мехлорэтамин, прокарбазин, хлорамбуцил, мелфалан, бусульфан, кармустин, цисплатин, карбоплатин, этопозид, тенипозид, митоксантрон, эпирубицин и доксорубицин.
- Семейный анамнез: наличие близкого родственника – родителя, брата, сестры или детей – с данным диагнозом увеличивает риск развития данного заболевания.
Симптомы острого миелоидного лейкоза
Признаки лейкоза проявляются примерно одинаково как у детей, так и у взрослых, и могут выглядеть следующим образом:
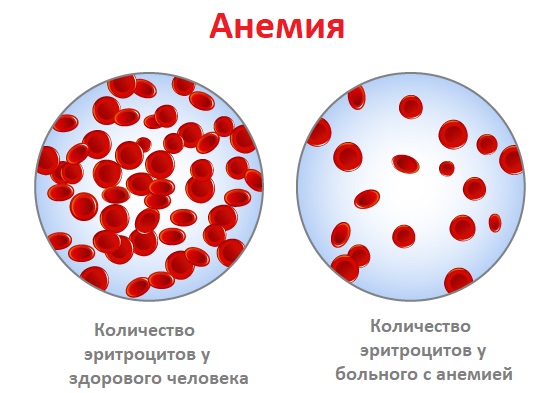
- Обычно одними из первых симптомов становятся чрезмерная утомляемость и слабость. Они возникают из-за анемии – снижения количества красных кровяных телец, переносящих кислород ко всем тканям организма.
- Головокружения – еще один частый спутник заболевания. Самая вероятная причина их появления – все та же анемия, из-за которой мозгу не хватает О2.
- Внезапное снижение веса: как правило, люди худеют уже на ранних стадиях заболевания, в том числе из-за уменьшившегося аппетита.
- Синяки или кровоизлияния: по мере развития острого миелоидного лейкоза костный мозг производит все меньше тромбоцитов – клеток, отвечающих за свертывание крови. Когда их становится слишком мало, у человека легко появляются синяки и красные или фиолетовые пятна на коже, кровь идет из носа и десен, ее следы обнаруживаются в моче или стуле, а менструации становятся более обильными.
- Повышенная температура в любое время суток и ночная потливость: часто бывают вызваны в том числе инфекциями, развивающимися при нарушении работы кроветворной системы.
- Бледная или холодная кожа, а также чувствительность к низким температурам, вызванные анемией.
- Кровоточивость, боль и отеки десен: может быть признаком тромбоцитопении – нехватки необходимых для правильной свертываемости крови тромбоцитов.
- Одышка – ощущение нехватки воздуха: на ранних этапах лейкоза она обычно спровоцирована нехваткой переносящих кислород клеток, а на поздних может быть вызвана тромбоэмболией – закупоркой легочной артерии. Это серьезное осложнение вызывает целый комплекс симптомов, таких как боль в груди, шее, плечах, руках и челюсти, тревожность и беспокойство, аритмия – неправильный ритм сердцебиения, тахикардия – слишком частое сокращение сердца, и обмороки.
- Частые инфекции – еще один признак заболевания, который появляется из-за присутствия в организме большого количества измененных белых кровяных телец. Их избыток приводит к нехватке нормальных нейтрофилов – клеток, которые борются с бактериями и грибками.
- Лейкостаз: скопление измененных клеток в сосудах, что приводит к появлению похожих на инсульт Инсульт – это нарушение кровообращения в головном мозге. симптомов: сонливости, головным болям, онемению лица, нехватке воздуха, нарушениям зрения, слабости и даже проблемам с речью.
- Вздутие живота: не самая распространенная проблема у обладателей острого миелоидного лейкоза. Она возникает при накоплении неправильных клеток в селезенке и печени, что приводит к нарушению пищеварения.
- Сыпь или уплотнения: наблюдаются примерно у 10% пациентов. Их наличие может говорить о распространении болезни на кожу.
- Еще один возможный симптом – боль в суставах и костях из-за присутствия в них большого количества измененных клеток.
- Головные боли – могут быть признаком как анемии, так и повреждения мозга.
- Увеличение лимфатических узлов – наших крошечных «фильтров», задерживающих и обезвреживающих опасные вещества. Часто они ощущаются как небольшие образования размером с горошину – под кожей в области шеи, подмышек или паха.
Диагностика острого миелоидного лейкоза
Тщательная диагностика крайне важна, поскольку в ее ходе доктор может не только установить сам факт наличия заболевания, но и понять, какое именно лечение подходит конкретному пациенту.
Диагностика начинается с обычного медицинского осмотра и поисков синяков, кровоподтеков или возможных признаков инфекции, после чего назначается целый ряд процедур:
- Анализы крови: позволяют видеть ее состав, обнаруживать измененные клетки, а также оценивать работу внутренних органов, таких как печень или почки.
- Сбор образцов костного мозга: процедура обязательная, поскольку именно в нем начинает развиваться заболевание. Как правило, пробы забирают из задней части тазовой или грудной костей в ходе двух болезненных, одновременно проводимых процедур. При аспирации пациент ложится на бок или живот, врач очищает кожу бедра, обезболивает ткани и вводит в них тонкую иглу, после чего шприцем отсасывает небольшое количество жидкого костного мозга. При биопсии специалист с помощью более толстой иглы удаляет еще и небольшие кусочки кости.
- Анализ спинномозговой жидкости – люмбальная, или спинномозговая пункция: назначается, если у человека есть симптомы, которые могут быть вызваны распространением измененных клеток в головной или спинной мозг. При сборе образцов доктор обезболивает участок кожи в нижней части спины над позвоночником, и вводит небольшую иглу в область между позвонками.
- Молекулярные и генетические тесты: необходимы для обнаружения мутаций, или изменений, в генах. Такие данные необходимы врачам для подбора оптимального лечения.
- Визуальные исследования – УЗИ, рентген, КТ, МРТ или ПЭТ: создают изображения внутренних тканей тела. Их назначают не для выявления лейкоза как такового, а для обнаружения инфекций, других проблем со здоровьем или определения запущенности заболевания, если специалисты считают, что оно распространилось за пределы костного мозга.
Лечение острого миелоидного лейкоза
Борьба с лейкозом – задача сложная и требует участия сразу нескольких врачей – не только гематолога, но и онколога, химиотерапевта и других.
В Онкоцентре «Лапино-2» есть целая команда отличных специалистов, которые не просто быстро выявят заболевание, но и проведут любые необходимые лечебные процедуры.
Вам не придется задаваться вопросом «что делать?» и «к кому обращаться?» – у нас вы получите четкий план действий, следуя которому пройдете терапию без очередей, задержек и нервов.

При лечении миелоидного лейкоза врачи применяют несколько методов.
-
Химиотерапия – уничтожение измененных клеток специальными препаратами. Такие вещества вводятся с помощью капельниц или принимаются в виде таблеток, попадают в кровь и распространяются по всему организму.
- Индукция ремиссии: первая фаза, задача которой заключается в быстром сокращении как можно большего количества лейкозных клеток. Во время ее проведения человек обычно находится в лечебном учреждении, поскольку лекарства разрушают не только неправильные, но и нормальные клетки костного мозга. В результате такого воздействия на организм показатели крови становятся опасно низкими, из-за чего самочувствие больного ухудшается. Многим людям приходится принимать антибиотики и препараты, повышающие количество белых кровяных телец, а некоторым требуется переливание крови. Примерно через неделю после окончания химиотерапии врач проводит биопсию и изучает состояние изъятых тканей. У большинства пациентов после первого же курса наступает ремиссия – бласты Бласты – это быстро растущие незрелые, не работающие белые кровяные тельца. составляют не более 5% от общего объема костного мозга. Если анализы выявляют их избыток, человеку назначают повторное лечение, либо рекомендуют пересадку стволовых клеток Стволовые клетки, производимые костным мозгом, могут становиться: красными кровяными тельцами, переносящими кислород по телу; лейкоцитами, помогающими бороться с инфекциями; и тромбоцитами, которые останавливают кровотечения.) . Во время этапа индукции все бласты обычно убить не получается – небольшая их часть все же остается в организме. В таком случае терапию нужно продолжить, поскольку иначе заболевание может вернуться в течение нескольких месяцев.
- Консолидация – вторая фаза, назначаемая для полного уничтожения измененных клеток и предотвращения рецидива – повторного развития лейкоза. Ее схема подбирается индивидуально для каждого пациента – она зависит не только от общего состояния здоровья человека, но и от его возраста.
- аллогенную трансплантацию клеток подходящего донора – близкого родственника, такого как брат или сестра, или другого добровольца;
- или пересадку аутологичных – собственных стволовых клеток человека, изъятых и замороженных еще до начала курса «химии».
- одни блокируют белки, которые помогают неправильным клеткам расти;
- вторые помогают им превращаться в нормальные;
- третьи убивают их при попытке разделения для создания новых;
- четвертые нацелены на белки, помогающие им жить слишком долго;
- пятые снижают выживаемость и уменьшают рост лейкозных клеток.
- при распространении заболевания за пределы костного мозга и крови: например, в мозг, спинномозговую жидкость или яички;
- перед трансплантацией стволовых клеток Стволовые клетки, производимые костным мозгом, могут становиться: красными кровяными тельцами, переносящими кислород по телу; лейкоцитами, помогающими бороться с инфекциями; и тромбоцитами, которые останавливают кровотечения.) ;
- для сокращения опухолей, которые давят на трахею – дыхательное горло, и не позволяют человеку получать достаточное количество кислорода;
- для уменьшения боли в области пораженной кости, если этого не удалось добиться с помощью химиотерапии.
Статус острого миелоидного лейкоза после лечения
Долгосрочные прогнозы каждого пациента в немалой степени зависят от того, насколько хорошо и быстро заболевание поддается лечению: чем лучше первая реакция организма, тем оптимистичнее перспективы.
Ремиссия – отсутствие признаков лейкоза: в костном мозге содержится меньше 5% бластов Бласты – это быстро растущие незрелые, не работающие белые кровяные тельца. , а количество клеток крови находится в пределах нормы. Полная молекулярная ремиссия означает, что врачам не удалось обнаружить измененные клетки даже с помощью очень чувствительных тестов.
Минимальная остаточная болезнь , МОБ: данный термин используется в тех случаях, когда после проведения терапии неправильные клетки не обнаруживаются обычными методами – например, при стандартном осмотре образцов под микроскопом, но выявляются при проведении современных точных исследований.
Активное заболевание: после лечения в костном мозге есть больше 5% бластов, либо после проведенной терапии произошел рецидив – возвращение болезни.

Прогнозы и выживаемость при остром миелоидном лейкозе
Перспективы каждого человека индивидуальны и зависят от большого количества факторов.
Немаловажную роль играет возраст – например, люди старше 60 обычно уже имеют хронические проблемы со здоровьем, которые усугубляют ситуацию. Кроме того, их организм тяжело переносит сильнодействующие химиотерапевтические препараты и другие виды лечения. По данным исследований , только 40% пациентов в возрасте от 65 лет способны получать подобные вещества на протяжении 3 месяцев.
Для каждого вида заболевания есть своя статистика.
После индукции – первого же курса химиотерапии выходят в ремиссию, то есть нормализуют количество клеток крови, около 90% обладателей острого промиелоцитарного лейкоза. Для всех остальных типов эта цифра составляет примерно 67%.
Кроме того, многие люди 60+ не реагируют на лечение, и всего лишь у половины из них после индукции наступает ремиссия.
Пятилетняя выживаемость – вероятность прожить 5 или больше лет с даты постановки диагноза, для взрослых составляет около 27,4% . Это означает, что спустя 5 лет с момента обнаружения заболевания в живых остается 27,4% пациентов.
У детей статистика своя: от 85% до 90% из них выходят в ремиссию после индукции, а их пятилетняя выживаемость составляет от 60% до 70%.
Острый миелобластный лейкоз

Острым миелобластным лейкозом (наиболее часто используемая аббревиатура — ОМЛ) называют злокачественную патологию крови и костного мозга, характеризующуюся бесконтрольным продуцированием незрелых (бластных) миелоцитарных клеток — эритроцитов, гранулоцитов, нейтрофильных лейкоцитов, тромбоцитов. Заболевание диагностируется в случаях, когда в миелограмме обнаруживается свыше 20% незрелых клеток. Его характерной особенностью является быстрое течение: в течение нескольких месяцев незрелые клетки начинают преобладать в составе крови, из-за чего она перестаёт выполнять свои основные функции. Состояние больного резко ухудшается, и при отсутствии лечения прогноз крайне неблагоприятен.
Онкогематологи различают несколько десятков разновидностей острого миелоидного лейкоза, которые группируются по сходным признакам:
- с типичными генетическими мутациями;
- с дисплазией, обусловившей изменение клеток;
- возникшие в результате лечения других заболеваний;
- с разрастанием миелоидного ростка на фоне синдрома Дауна;
- миелоидные саркомы;
- дендритноклеточные плазмацитоидные опухоли.
В зависимости от формы заболевания врач выбирает тактику лечения, так как продолжительность ремиссий и общий прогноз для разных видов имеют серьёзные отличия.
Симптомы
В начальной стадии острого миелобластного лейкоза симптомы практически отсутствуют, с развитием болезни у пациента развиваются:
- бледность кожи и другие признаки анемии;
- кровотечения из носа и дёсен, многочисленные кровоподтёки на коже;
- повышенная температура в пределах 37-38 градусов (субфебрильная);
- обильное выделение пота по ночам;
- сыпь на коже в виде мелких красноватых пятнышек;
- одышка даже после небольших нагрузок;
- постоянные боли в костях и суставах;
- частые простудные и другие инфекции;
- увеличенные лимфоузлы;
- резкое снижение веса без видимых причин.
Причины и факторы риска
В настоящее время неизвестно, какие именно воздействия побуждают ростки крови к злокачественным мутациям, однако онкологи хорошо изучили факторы, способствующие развитию острого миелобластного лейкоза.
- Воздействие канцерогенов. Некоторые химические соединения могут побуждать клетки к изменению. Это ряд продуктов, образующихся во время курения табака и неполного окисления жиров, многие виды промышленных выбросов, некоторые лекарственные препараты и т. д.
- Излучение. Рентгеновские лучи и другие радиоактивные, ионизирующие излучения изменяют наследственный аппарат живых клеток.
- Генетический фактор. Риск заболевания повышается в несколько раз для людей, у которых близкие родственники болели лейкозом.
- Заболевания. Некоторые болезни увеличивают вероятность рака крови. Это синдром Дауна, врождённая анемия и тромбоцитопения, нейрофиброматоз и т. д.
Диагностика
Лабораторные анализы крови и образцов костного мозга являются основными способами диагностики острого миелобластного лейкоза. Это:
- общий анализ периферической крови;
- миелограмма;
- цитохимический анализ незрелых клеток;
- иммунофенотипирование;
- цитогенетический анализ;
- молекулярно-генетический анализ;
- HLA-типирование;
- биохимический анализ крови;
- проба Реберга;
- коагулограмма.
Кроме того, пациенту назначают инструментальные исследования внутренних органов для оценки их состояния: УЗИ брюшной полости, ЭКГ, рентген грудной клетки. Впоследствии могут быть назначены другие анализы и исследования.
Лечение
Основным методом лечения острого миелобластного лейкоза является химиотерапия, которая проводится в два этапа:
- индукция — снижение количества незрелых клеток для достижения ремиссии;
- консолидация — максимальное продление ремиссии, предотвращение рецидивов, устранение остаточных явлений.
Интенсивная терапия, применяемая на этапе индукции, позволяет достигнуть ремиссии примерно в 70% клинических случаев. Но заканчивать на этом лечение категорически не следует, так как без программы консолидации у пациентов практически всегда спустя некоторое время наступает рецидив.
Консолидационный этап, в зависимости от состояния больного, включает до пяти курсов химиотерапии. Если риск рецидива достаточно высок, проводится пересадка костного мозга и/или стволовых клеток кроветворения. Лучшими донорами считаются родные братья и сёстры, особенно однояйцевые близнецы.
Кроме того, пациентам часто назначают введение эритроцитарной массы, трансфузионную терапию (переливания крови и её препаратов). Тактика лечения обычно выбирается в соответствии с возрастом пациента. Ремиссия считается достигнутой, если количество миелобластных клеток в костном мозге удаётся снизить до 20% и менее.
Прогнозы
При остром миелоидном лейкозе прогноз жизни зависит от возраста больного — после 60 лет шансы на выздоровление составляют 20-25%, тогда как у более молодых пациентов они достигают 70, а в некоторых клиниках и 90%. Ухудшают перспективы выздоровления генетические заболевания (болезнь Дауна и др.). В случае, если рак крови носит вторичный характер, возможно только паллиативное лечение.
Профилактика
Специфических способов предупреждения острого миелоцитарного лейкоза не существует. Чтобы вовремя начать лечение, необходимо регулярно проходить профилактические обследования, сдавать анализы. Пациентам, завершившим курс лечения, не рекомендуется менять климатическую зону постоянного проживания. Кроме того, им следует отказаться от физиотерапевтических процедур.
Реабилитация
Химиотерапия и особенно пересадка костного мозга создают огромную нагрузку на организм, поэтому пациент должен строго соблюдать все клинические рекомендации при остром миелобластном лейкозе, чтобы достигнуть выздоровления. Они включают процедуры выведения токсинов из крови, строгое соблюдение правил антисептики, меры по повышению иммунитета и восстановлению микрофлоры кишечника. Большое значение придаётся антистрессовой терапии и профилактике депрессии, улучшению качества сна.
Диагностика и лечение острого миелобластного лейкоза в Москве
Клиника Института ядерной медицины проводит диагностические исследования для выявления острого миелобластного лейкоза. В случае подтверждения диагноза вы можете пройти лечение у квалифицированных онкогематологов, врачей высшей категории. Регулярное участие в международных конференциях и семинарах, стажировки в зарубежных клиниках позволяют нашим специалистам овладевать самыми передовыми медицинскими методиками для успешного лечения пациентов.
Вопросы и ответы
Почему при лечении острого миелобластного лейкоза возникают побочные эффекты?
Воздействие химиопрепаратов убивает не только бластные онкоклетки, но и здоровые клетки крови, что приводит к развитию интоксикации организма, проявляющейся в тошноте, слабости, повышенной подверженности инфекциям. Чтобы минимизировать этот эффект, используют различные поддерживающие меры — переливание препаратов крови, лейкаферез и другие процедуры.
Сколько живут с острым миелобластным лейкозом?
Возможность прожить более пяти лет у пациентов с острым миелоидным лейкозом зависит от формы заболевания и возраста. В некоторых случаях выживаемость составляет менее 20%, при других формах болезни превышает 70%. Шансы на выздоровление существуют всегда, а повысить их можно, обратившись в хорошую клинику с современным медицинским оборудованием и опытными онкогематологами.
Когда проводят трансплантацию при остром миелобластном лейкозе?
Оптимальный период для трансплантации — после достижения первой ремиссии. Она показана при высоком риске рецидива, при обнаружении цитогенетических изменений в поражённых клетках, а также при наличии других заболеваний крови. Как правило, в случае успешного восстановления после пересадки рецидивов болезни не происходит.
Лейкоз
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лейкоз: причины появления, симптомы, диагностика и способы лечения.
Определение
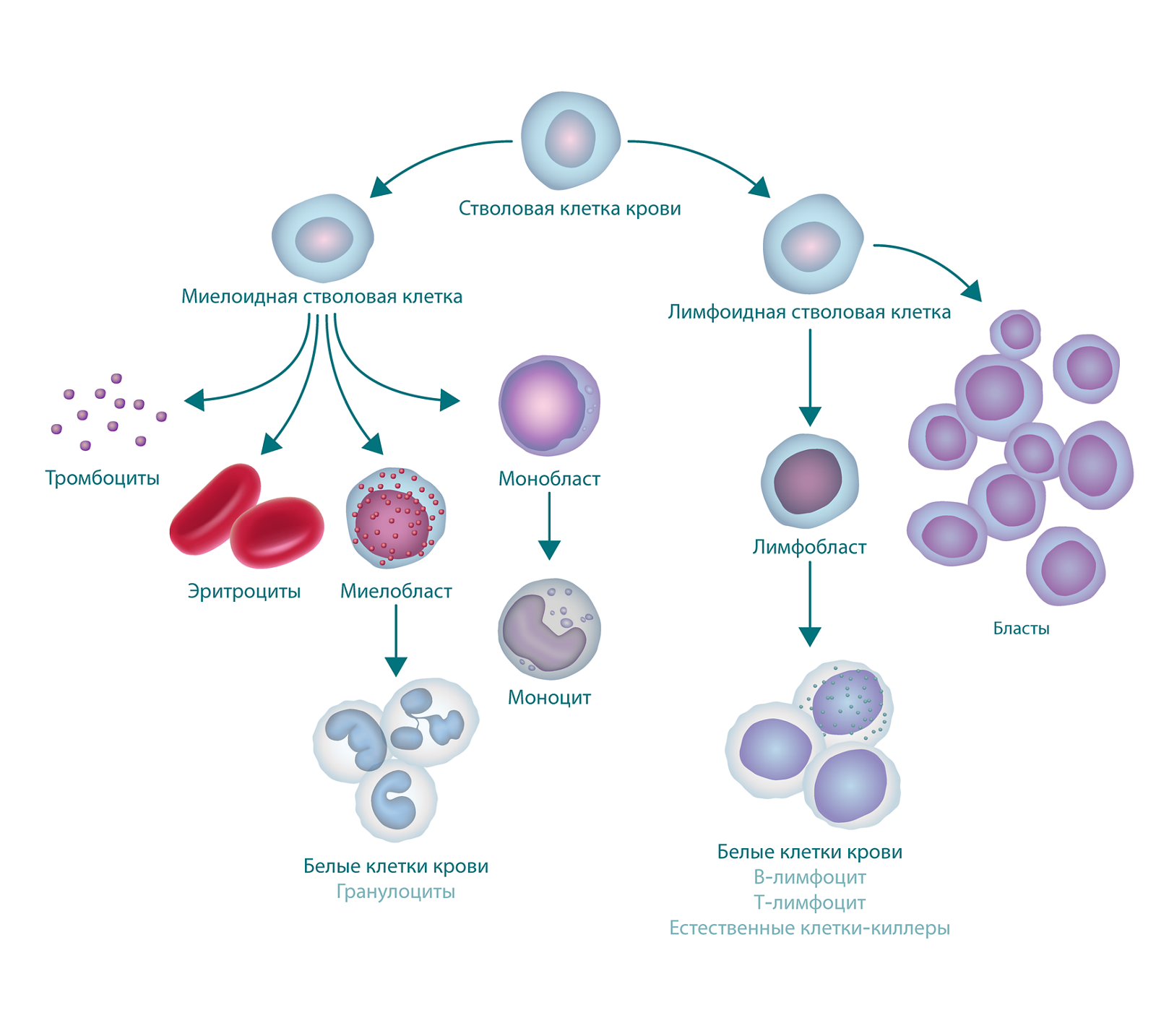
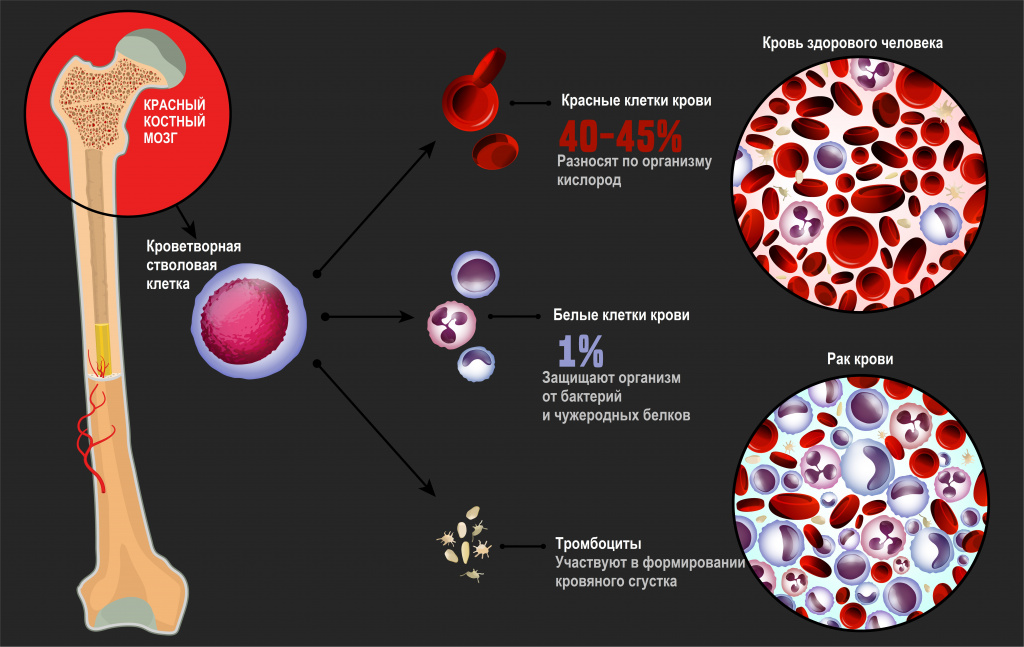
Лейкозы – большая группа заболеваний кроветворной системы. Кроветворение (гемопоэз) – это многоэтапный процесс образования форменных элементов крови в специализированных органах кроветворения. К форменным элементам крови относятся лейкоциты (белые кровяные тельца), которые участвуют во врожденном и приобретенном иммунитете, эритроциты (красные кровяные тельца), которые осуществляют транспорт кислорода и углекислого газа, и тромбоциты, обеспечивающие свертываемость крови.
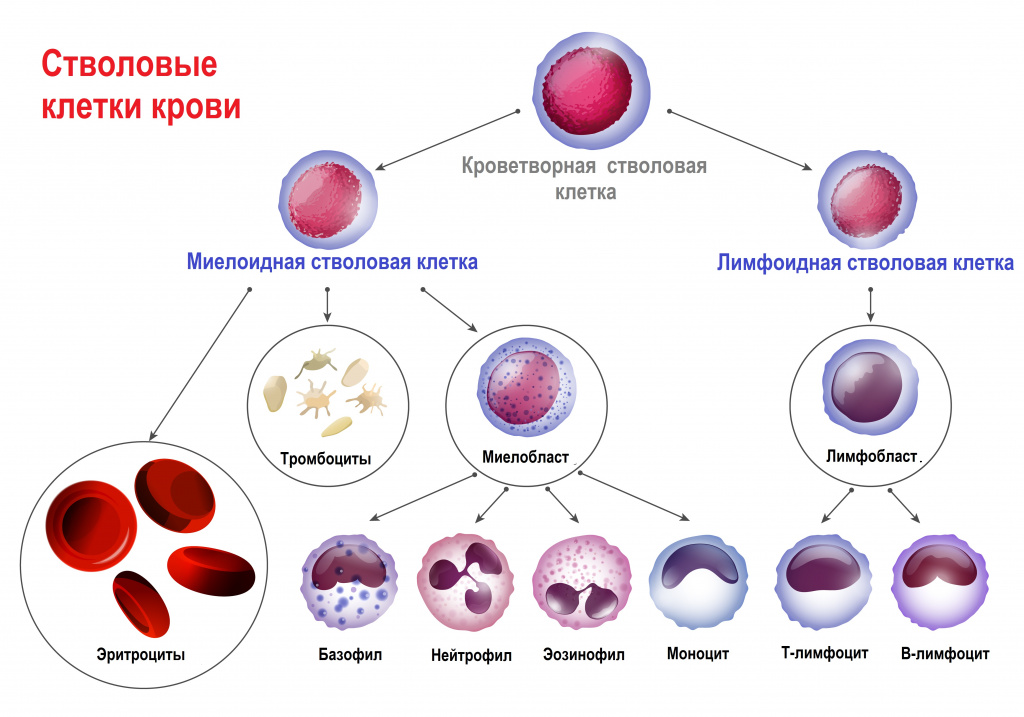
У всех клеток крови есть одна общая «родоначальница» – полипотентная стволовая клетка. Термин «полипотентная» означает, что такая клетка может развиваться в различные виды зрелых клеток.
Главный орган, где располагаются полипотентные стволовые клетки, – костный мозг, который как раз и поражается при лейкозах.
В результате повреждения (мутации) в генетическом материале полипотентной стволовой клетки-предшественницы нарушается процесс созревания клеток. При остром лейкозе возникает большое количество незрелых (бластных) клеток, из которых образуется опухоль, разрастается в костном мозге, замещает нормальные ростки кроветворения и имеет тенденцию к метастазированию – распространению с током крови или лимфы в здоровые органы. При хронических лейкозах заболевание течет годами, происходит частичная задержка созревания клеток и опухоль образуется из созревающих и зрелых клеток.
Причины возникновения лейкозов
К факторам риска развития лейкоза относятся:
- ионизирующая радиация: лучевая терапия по поводу других опухолей, облучение на рабочем месте, ультрафиолетовое излучение;
- воздействие на организм химических канцерогенных веществ;
- некоторые вирусы: HTLV (Т-лимфотропный вирус человека);
- бытовые факторы: добавки в пищевые продукты, курение, плохая экологическая обстановка;
- наследственная предрасположенность к раковым заболеваниям.
Лейкозы подразделяют на острые и хронические, а по типу поражения ростка кроветворения – на лимфоидные и миелоидные. Острый лейкоз никогда не переходит в хронический, а хронический не может стать острым (но его развитие может перейти в стадию бластного криза).
В зависимости от преобладания тех или иных опухолевых клеток выделяют бластные, цитарные и недифференцированные лейкозы.
Острый лимфобластный лейкоз (ОЛЛ) диагностируется у лиц любого возраста, начиная с младенческого и заканчивая пожилым, однако пик заболеваемости приходятся на детский возраст (60% пациентов с ОЛЛ моложе 20 лет). Острый лимфобластный лейкоз – самая распространенная опухоль кроветворной ткани у детей, которая составляет 30% всех злокачественных опухолей детского возраста. Заболеваемость ОЛЛ у пациентов пожилого возраста неуклонно возрастает: так, ежегодная частота ОЛЛ увеличивается с 0,39 случая на 100 тыс. населения в возрасте 35–39 лет, до 2,1 случая на 100 тыс. населения в возрасте ≥85 лет. Кроме того, приблизительно 30% ОЛЛ диагностируются в возрасте ≥60 лет.
Острым миелоидным лейкозом (ОМЛ) страдает в среднем 3-5 человек на 100 тыс. населения в год. Заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12–13 случаев на 100 тыс. населения у лиц в возрасте старше 80 лет.
Хронический лимфобластный лейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых, в то время как у детей этот вид опухоли не регистрируется. В европейских странах его частота составляет 4 случая на 100 тыс. населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30 случаев на 100 тыс. в год.
Хронический миелолейкоз (ХМЛ) – редкое заболевание: 0,7 на 100 тыс. взрослого населения, пик заболеваемости приходится на 50-59 лет, однако до 33% больных ОМЛ – люди моложе 40 лет.
Симптомы лейкозов
Острый лейкоз в большинстве случаев дебютирует резко – внезапно повышается температура, появляются озноб, боль в горле, в суставах, отмечается резко выраженная слабость. Реже острый лейкоз может проявиться кровотечением. Иногда острый лейкоз начинается с постепенного ухудшения состояния больного, появления невыраженной боли в суставах и костях, кровоточивости. В единичных случаях возможно бессимптомное начало заболевания. У многих больных увеличиваются лимфоузлы и селезенка.
При хроническом лейкозе на начальной стадии, которая длится от года до трех лет, пациенты могут ни на что не жаловаться. Иногда беспокоят слабость, потливость, частые простудные заболевания, могут отмечаться тупые, ноющие боли в костях.
При подавлении эритроидного ростка, дающего красные кровяные тельца, возникает анемия и гемическая гипоксия (снижение количества кислорода в крови). При этом пациенты отмечают слабость, утомляемость, бледность кожных покровов.
При поражении мегакариоцитарного ростка падает количество тромбоцитов, поэтому возникает кровоточивость десен, слизистой оболочки носа, пищеварительного тракта, образуются синяки, кровоизлияния в различные органы. При прогрессировании лейкоза могут развиваться массивные кровотечения в результате ДВС синдрома (синдрома диссеминированного внутрисосудистого свертывания).
В результате недостатка лейкоцитов и снижения иммунитета развиваются инфекционные осложнения различной степени тяжести, что чаще всего проявляется лихорадкой.
Могут возникать язвенно-некротическая ангина, перитонзиллярные абсцессы, некротический гингивит, стоматит, пиодермия, параректальные абсцессы, пневмония, пиелонефрит. Существует значимый риск тяжелого течения инфекционных осложнений вплоть до развития сепсиса.
С током крови и лимфы опухолевые клетки попадают в здоровые органы, нарушают их структуру и функцию – наиболее подвержены метастатическим процессам печень, селезенка, лимфатические узлы, но метастазы могут поражать и кожу, и мозговые оболочки, и почки, и легкие.
Основные причины летальности у пациентов с лейкозом связаны с тем, что осложнения могут спровоцировать развитие сепсиса, полиорганную недостаточность, кровоизлияния в различные органы. Острый лейкоз без лечения приводит к смертельному исходу в течение нескольких недель или месяцев.
Диагностика лейкозов
Диагностика лейкозов основывается на оценке морфологических особенностей клеток костного мозга и периферической крови. Поэтому всем пациентам с подозрением на лейкоз назначают общий анализ крови с подсчетом лейкоцитарной формулы и определением числа тромбоцитов.
Клинический анализ крови – одно из основных лабораторных исследований для количественной и качественной оценки всех классов форменных элементов крови. Включает цитологическое исследование мазка крови с подсчетом процентного содержания разновидностей лейкоцитов (определение общего количества лейкоцитов и процентного соотношения основных субпопуляций лейкоцитов: нейтрофилов, лимфоцитов, моноцитов, эозинофилов и базофилов) и определение скорости оседания эритроцитов.
Для определения объема опухолевого поражения, вероятности развития синдрома лизиса опухоли рекомендовано выполнение общетерапевтического биохимического анализа крови: АСТ, АЛТ, общий билирубин, глюкоза, мочевина, креатинин, общий белок, ЛДГ, магний, натрий, калий, кальций.
Определение уровня АЛТ в сыворотке крови применяют преимущественно в диагностике и контроле течения болезней печени, а также в комплексных биохимических исследованиях.
Определение уровня АСТ в сыворотке крови используют преимущественно в диагностике и контроле течения болезней печени, а также в комплексных биохимических исследованиях.
Определение уровня билирубина в сыворотке крови используют для выявления поражений печени различного происхождения, закупорки желчных путей, гемолитической анемии, желтухи новорожденных.
Глюкоза – основной источник энергии для метаболических процессов в организме человека, является обязательным компонентом большинства внутриклеточных структур, участвует в синтезе нуклеиновых кислот (рибоза, дезоксирибоза), образует соединения с белками (гликопротеиды, протеогликаны) и липидами (гликолипиды).
Мочевина – конечный продукт расщепления белковых молекул, выводимый из организма почками. Определение уровня мочевины в сыворотке крови используют для оценки выделительной функции почек и контроля эффективности лечения пациентов с почечными заболеваниями.
Креатинин – продукт метаболизма мышечных клеток, удаляется из крови почками. Тест используют в качестве маркера функции почек для диагностики и мониторинга острых и хронических болезней почек, а также в скрининговых обследованиях.
Общий белок выступает показателем белкового обмена, отражающим содержание всех фракций белков в сыворотке крови. Тест используется в комплексных биохимических обследованиях пациентов при различных заболеваниях.
Лактатдегидрогеназа – гликолитический фермент, участвующий в конечных этапах превращений глюкозы. Тест используют в диагностике различных заболеваний (сердца, печени, мышц, почек, легких, системы крови).
Магний – один из основных катионов организма. Исследование магния в сыворотке крови в комплексе с другими электролитами используют для выявления нарушений электролитного баланса.
Определение уровня калия, натрия и хлора в сыворотке крови используется для скрининга электролитов и исследования кислотно-щелочного дисбаланса.
Общий кальций – основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функциями в организме.
Для определения вероятности развития тяжелых коагуляционных нарушений (как геморрагических, так и тромботических) рекомендовано исследование свертывающей системы крови.
Базовый набор тестов, применяемый для скрининговой оценки состояния свертывающей системы крови.
С целью исключения поражения почек выполняют общий анализ мочи.
Общий анализ мочи – комплексная оценка ряда физических и химических параметров мочи, а также элементов мочевого осадка, нацеленное на выявление патологии почек и мочевыводящих путей.
Диагностику хронического лейкоза проводят с помощью иммунофенотипического исследования лимфоцитов крови (ИФТ) методом проточной цитометрии.
Рекомендовано проведение стернальной пункции (пункции грудины) для получения цитологического препарата костного мозга и цитологическое и цитохимическое исследование мазка с целью уточнения диагноза и определения прогноза.
В ряде случаев показана биопсия опухолевого образования или лимфатического узла (или другого метастатического очага) и патологоанатомическое исследование полученного биопсийного материала.
Кроме того, врач может рекомендовать проведение иммунофенотипирования гемопоэтических клеток-предшественниц в костном мозге, цитогенетическое исследование аспирата костного мозга, молекулярно-генетические исследования мутаций в генах и др.
Из инструментальных методов диагностики проводятся:
-
эхокардиография для оценки функционального состояния сердечной мышцы;
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
Лечение лейкозов
Лечение лейкозов проводится в стационаре. Медикаментозное воздействие на опухоль специальными препаратами, губительно действующими на быстро делящиеся клетки, называется химиотерапией. При лечении острых лейкозов химиотерапию проводят в несколько этапов: индукция ремиссии, консолидация (закрепление) ремиссии, поддерживающая терапия и профилактика нейролейкемии (метастазирования опухолевых лейкозных клеток в головной и спинной мозг).
Период индукции ремиссии – это начальный этап, цель которого максимально уменьшить опухолевую массу и достичь ремиссии. Обычно для этого требуется 1-2 курса химиотерапии. Далее идет консолидация достигнутого эффекта – наиболее агрессивный и высокодозный этап лечения, задачей которого является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток. Этот этап также занимает 1-2 курса. За ним следует противорецидивное или поддерживающее лечение. При некоторых вариантах острых лейкозов требуется профилактика или, при необходимости, лечение нейролейкемии.
Для разных видов лейкозов у разных возрастных групп профессиональными сообществами разработаны схемы химиотерапии.
При лечении ХМЛ основными препаратами выбора являются ингибиторы тирозинкиназы, применяемые в непрерывном режиме – ежедневно, длительно, постоянно. Перерывы в приеме могут способствовать снижению эффективности терапии и прогрессированию заболевания. В случае неэффективности терапии может быть проведена трансплантацию гемопоэтических стволовых клеток или костного мозга.
В терапии ХЛЛ цели и схемы терапии химиотерапии определены возрастом пациента, числом и тяжестью сопутствующих заболеваний. Разработаны протоколы лечения для разных пациентов, в том числе схемы моно- и полихимиотерапии. Для профилактики инфекционных осложнений применяют внутривенное введение иммуноглобулина, рекомендована вакцинация от гриппа и пневмококковой инфекции.
Помимо химиотерапии пациенту может потребоваться трансфузионная терапия: переливание эритроцитарной массы, тромбоцитарной массы, изотонических растворов.
При присоединении инфекций показана антибиотикотерапия. На фоне лечения могут возникать тромботические осложнения, что требует антикоагулянтной терапии. Пациентам высокого риска в связи с вероятностью рецидива лейкоза применяют трансплантацию гемопоэтических стволовых клеток.
Осложнения
Основные осложнения лейкозов – инфекционные, вплоть до сепсиса, и тромботические и/или геморрагические осложнения с развитием синдрома диссеминированного внутрисосудистого свертывания. При метастазировании опухолевых клеток развивается полиорганная недостаточность, в т.ч. лейкозные клетки могут попадать в оболочки головного и спинного мозга, инфильтрировать периферические нервы с развитием разнообразных двигательных и чувствительных нарушений (лейкемоидная инфильтрация). Кроме того, встречается так называемый «синдром лизиса опухоли» – сложный процесс, возникающий в результате спонтанного или вызванного лечением разрушения большого числа опухолевых клеток с выходом внутриклеточного содержимого в кровоток. При этом может развиться острая почечная недостаточность. Летальность при лизисе опухоли достигает 70%.
Профилактика лейкозов
Так как причины возникновения лейкозов не установлены, методов специфической профилактики до сих пор не существует.
Однако доказано, что между курением и риском развития острого лейкоза существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет.
Ряд исследователей предполагают, что около 20% случаев ОМЛ являются следствием курения.
- Клинические рекомендации «Острые миелоидные лейкозы». Общероссийский национальный союз «Ассоциация онкологов России», некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга «Национальное гематологическое общество», 2020.
- Клинические рекомендации «Острые лимфобластные лейкозы». Общероссийский национальный союз «Ассоциация онкологов России», некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга «Национальное гематологическое общество», 2020.
- Клинические рекомендации «Хронический лимфоцитарный лейкоз/ лимфома из малых лимфоцитов». Общероссийский национальный союз «Ассоциация онкологов России», некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга «Национальное гематологическое общество», региональная общественная организация «Общество онкогематологов», 2020.
- Клинические рекомендации «Хронический миелолейкоз у взрослых». Национальное гематологическое общество, 2017.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Острый миелоидный лейкоз
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обуславливает основные симптомы заболевания.
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»). Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты и другие клетки крови относятся к миелоидной линии. Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других клеток (такие лейкозы называют миелобластными, миелоидными или просто миелолейкозами).
Острый миелоидный лейкоз (ОМЛ, острый миелобластный лейкоз, острый миелолейкоз, острый нелимфобластный лейкоз) – заболевание, сравнительно редко встречающееся у детей, однако с возрастом частота его возрастает. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «миелоидный» (см. выше) означает, что незрелые клетки, составляющие основу болезни, принадлежат к так называемой миелоидной линии кроветворения. Эти клетки – как правило, миелобласты и их потомки, но возможно и присутствие других видов бластных клеток.
В рамках франко-американско-британской морфологической классификации (ФАБ, FAB) выделяют 8 основных вариантов ОМЛ.
Некоторые очень редкие варианты ОМЛ не включены в этот список. Варианты ОМЛ с М3 по М7, имеющие собственные названия и некоторые специфические особенности, более подробно рассмотрены в отдельных разделах нашего справочника.
Частота встречаемости, факторы риска
ОМЛ составляет у детей около 15% всех случаев онкологических заболеваний кроветворной системы, то есть встречается у них заметно реже, чем острый лимфобластный лейкоз. Среди детей до 14 лет частота ОМЛ составляет приблизительно 0.6-0.8 случаев на 100 тысяч человек в год, однако в возрасте после 40-45 лет происходит резкий подъем заболеваемости. Большинство больных ОМЛ – пожилые люди. В отличие от острого лимфобластного лейкоза, где пик заболеваемости наблюдается в детском возрасте, при ОМЛ дети составляют всего 10% больных.
В большинстве случаев ОМЛ невозможно назвать непосредственную причину заболевания. Однако некоторые факторы повышают вероятность возникновения ОМЛ: воздействие ряда химических препаратов, ионизирующей радиации (в том числе в ходе предшествующего лечения других онкозаболеваний). Иногда наблюдаются и случаи заболевания ОМЛ среди близких родственников, что говорит об определенной роли генетической предрасположенности. Но конкретные генетические особенности, повышающие риск развития лейкоза, во многих случаях пока не удается выделить, хотя исследования постоянно ведутся.
Развитию ОМЛ могут предшествовать некоторые заболевания кроветворной системы, такие как миелодиспластический синдром. Тогда говорят о вторичном лейкозе. Наконец, риск ОМЛ повышен при определенных генетически обусловленных аномалиях, включая синдром Дауна, анемию Фанкони и др.
Признаки и симптомы
ОМЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Ведущими, как правило, являются признаки анемии: утомляемость, бледность, одышка, снижение аппетита. Недостаток тромбоцитов проявляется повышенной кровоточивостью при порезах и ушибах, носовыми кровотечениями, «беспричинным» появлением синяков и кровоподтеков. Нередко встречаются устойчивые к лечению инфекции, так как у больного для борьбы с ними слишком мало «нормальных» (зрелых) лейкоцитов. Может возникнуть поражение слизистых оболочек рта и желудочно-кишечного тракта, припухлость десен. Нередко повышена температура тела, ощущаются боли в костях. Иногда возникают опухоли из лейкемических клеток вне костного мозга – миелосаркома.
Так как большинство симптомов может быть связаны и с другими заболеваниями и не специфично для ОМЛ, перед началом лечения необходимо уточнение диагноза на основании лабораторных методов, которое в срочном порядке производится в больничных условиях.
Диагностика
При ОМЛ возникают изменения в обычном клиническом анализе крови: недостаток эритроцитов и тромбоцитов, нередко избыток лейкоцитов, причем многие из них представлены незрелыми формами. Но надежно поставить диагноз можно только при исследовании образца костного мозга. Согласно критериям Всемирной организации здравоохранения, диагноз ОМЛ ставится, если содержание миелобластов в костном мозге не менее 20% (согласно франко-американо-британской классифиции FAB, пороговым значением является 30%).
Для лечения и оценки прогноза заболевания важно не только подтвердить диагноз «лейкоз», но и различить острый лимфобластный лейкоз и ОМЛ, разграничить лейкоз и миелодиспластический синдром, а также определить конкретный вариант ОМЛ (см. выше). Для этой цели применяется не только морфологическое исследование клеток (микроскопическое исследование специальным образом окрашенных препаратов), но и цитохимический анализ, а также иммунофенотипирование (изучение белков-антигенов на поверхности клеток). Цитогенетические исследования применяются для обнаружения хромосомных перестроек – в первую очередь транслокаций, имеющих большое значение для определения варианта болезни и прогноза. Возрастающую роль играют и молекулярно-генетические анализы.
Точная диагностика ОМЛ и его вариантов иногда представляет собой сложную задачу, требующую участия высококвалифицированных гематологов и гемопатологов в диагностическом процессе.
Как и при остром лимфобластном лейкозе, результаты диагностических исследований при ОМЛ используются для отнесения пациента к той или иной группе риска. Это необходимо для того, чтобы определить тактику лечения, оценить как вероятность ответа на химиотерапию, так и риск последующего рецидива. У пациентов, принадлежащим к группе низкого риска, больше шансов достичь долговременной ремиссии при стандартном химиотерапевтическом лечении, а при высоком риске для успеха терапии будет планироваться трансплантация костного мозга.
Группу риска определяют многие факторы. Перечислим некоторые из них:
Возраст: у больных среднего и пожилого возраста прогноз в среднем хуже, чем у детей и молодых людей.
Хромосомные изменения в лейкемических клетках. Так, транслокации t(15;17) или t(8;21) определяют у больных более низкий риск. В то же время, например, определенные цитогенетические изменения изменения связаны с ухудшением прогноза.
Вариант лейкоза. Некоторые варианты ОМЛ (такие как М0, М6, М7) связаны с высоким риском, а некоторые, напротив, сравнительно хорошо поддаются современной терапии (ОМЛ М3).
С более высоким риском связан вторичный лейкоз, возникший на фоне другого гематологического заболевания – такого как миелодиспластический синдром или анемия Фанкони, – или после прохождения лечения (химиотерапия, облучение) по поводу какой-либо злокачественной опухоли. Риск также повышается при рецидиве лейкоза.
Лечение
Главным методом лечения ОМЛ является химиотерапия. Как в случае острого лимфобластного лейкоза, лечение включает фазы индукции ремиссии и консолидации; иногда применяется также поддерживающая терапия.
Индукция ремиссии – интенсивная терапия, направленная на достижение ремиссии лейкоза. При большинстве вариантов ОМЛ индукция ремиссии производится при помощи интенсивной химиотерапии с использованием цитарабина (цитозара) и лекарств антрациклинового ряда (даунорубицин, идарубицин), иногда с добавлением других препаратов – например, этопозида или митоксантрона.
Специфической особенностью терапии при остром промиелоцитарном лейкозе (ОМЛ М3) является использование лекарства ATRA (полностью транс-ретиноевая кислота) или других лекарств с похожим действием (триоксид мышьяка).
Если в результате терапии индукции оказывается, что в костном мозге стало менее 5% бластных клеток (на фоне восстановления кроветворения) и у пациента нет других проявлений болезни, то констатируется достижение ремиссии.
В результате курсов индукции удается достичь ремиссии у большинства пациентов. Однако достигнутая ремиссия не может быть стойкой без терапии консолидации, то есть закрепления ремиссии. В фазе консолидации уничтожаются остаточные количества аномальных бластных клеток во избежание рецидива заболевания. Важнейшим препаратом в фазе консолидации при лечении ОМЛ является цитарабин, в том числе высокодозный; к нему часто добавляются другие препараты в разных сочетаниях.
При лечении рецидивов ОМЛ часто используются режимы химиотерапии, включающие в себя флударабин.
На этапах индукции и консолидации внутривенное введение химиотерапевтических препаратов производится в условиях больничного стационара.
Поддерживающая терапия используется далеко не во всех случаях (в отличие от острого лимфобластного лейкоза), однако при варианте ОМЛ М3 она важна. Эта терапия менее интенсивна, чем терапия индукции и консолидации, и не требует пребывания в больнице.
Иногда при ОМЛ к терапии добавляются современные таргетные препараты. Конкретные лекарства зависят от генетических особенностей опухолевых клеток. Например, при определенной генетической поломке эффективен препарат сорафениб.
Нейролейкемия менее характерна для ОМЛ, чем для острого лимфобластного лейкоза. Но иногда она встречается, чаще у детей при вариантах ОМЛ М3, М4 и М5. Для ее лечения и профилактики могут использоваться цитарабин, метотрексат и глюкокортикостероиды, вводимые интратекально, посредством люмбальной пункции спинномозгового канала.
Для снижения вероятности рецидива части пациентов показана трансплантация костного мозга. При ОМЛ она используется чаще, чем при остром лимфобластном лейкозе. Показаниями к трансплантации могут служить, например,
вариант болезни, связанный с более высоким риском (см. выше),
цитогенетические изменения в лейкемических клетках, связанные с высоким риском,
вторичный ОМЛ, развившийся на фоне миелодиспластического синдрома или другой болезни крови, или же после предшествующего лечения злокачественных опухолей.
Вероятность успеха трансплантации максимальна, если проводить ее после достижения первой ремиссии. У детей трансплантации производятся чаще, чем у взрослых, и в среднем более успешны. Постоянно ведется работа над совершенствованием режимов трансплантации.
В ходе интенсивной химиотерапии ОМЛ практически всегда в той или иной мере подавляется нормальное кроветворение. Поэтому многим больным ОМЛ необходимы переливания компонентов крови: тромбоцитов во избежание кровотечений и эритроцитов для лечения анемии.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения часто необходимы эффективные антибактериальные, противогрибковые и противовирусные лекарства для профилактики и терапии инфекционных осложнений. Опасность представляют как обычные, так и оппортунистические инфекции.
Лечение ОМЛ накладывает ограничения на образ жизни больного. В ходе интенсивной химиотерапии необходимо соблюдать диету и строгие правила гигиены, а также минимизировать контакты с внешним миром во избежание инфекций. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Общая продолжительность лечения при различных формах ОМЛ составляет от нескольких месяцев до (в случае варианта М3) 2-3 лет.
Постоянно появляются новые таргетные лекарства, которые помогают излечивать больных со сложными случаями ОМЛ. Так, некоторым пациентам помогает венетоклакс («Венклекста») и/или даратумумаб («Дарзалекс»). Иногда используется конъюгированный препарат гемтузумаб озогамицин («Милотарг»). Кроме того, совершенствуются протоколы трансплантации костного мозга.
Прогноз
Без лечения ОМЛ, как правило, приводит к гибели больного в течение нескольких месяцев, иногда даже нескольких недель. Однако при современном лечении многих можно спасти. Прогноз зависит от конкретного варианта лейкоза, хромосомных особенностей лейкемических клеток, возраста, общего состояния больного и других факторов.
В настоящее время медицина в развитых странах способна излечить более 65% детей, заболевших ОМЛ. В частности, постоянно улучшаются результаты трансплантации костного мозга. В среднем и пожилом возрасте, к сожалению, вероятность излечения существенно ниже.
Следует отметить, что большинство пациентов с ОМЛ – это именно пожилые больные. По сравнению с молодыми они тяжелее переносят лечение и хуже на него отвечают. Лишь у меньшинства пациентов старше 60 лет удается достичь длительной ремиссии. Для остальных зачастую основным становится поддерживающее лечение (борьба с инфекциями, переливания компонентов крови, обезболивание) для продления жизни и улучшения ее качества.
Как лечится острый миелобластный лейкоз?

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Общая стратегия лечения острого миелобластного лейкоза
В современной гематологии терапию лейкозов, в том числе и острого миелобластного, необходимо проводить в специализированных стационарах по строгим программам. Программа (протокол) включает перечень необходимых для диагностики исследований и жёсткий график их проведения. После завершения диагностического этапа пациент получает лечение, предусмотренное этим протоколом, с жёстким соблюдением сроков и порядка элементов терапии. В настоящее время в мире существуют несколько ведущих исследовательских групп, анализирующих диагностику и лечение острого миелобластного лейкоза у детей в мультицентровых исследованиях. Это американские исследовательские группы CCG (Children’s Cancer Group) и POG (Pediatric Oncology Group), английская группа MRC (Medical Research Council), немецкая группа BFM (Berlin-Frankfurt-Miinster), японская CCLG (Children’s Cancer and Leukemia Study Group), французская LAME (Leucamie Aique Mycloi’de Enfant), итальянская AIEOP (Associazione Italiana Ematologia ed Oncologia Pediatric) и др. Результаты их исследований – основные источники современных знаний о диагностике, прогнозе и лечении острого миелобластного лейкоза у детей.
Основная цель лечения – эрадикация лейкемического клона с последующим восстановлением нормального гемопоэза.
Первый этап – индукция ремиссии. Для прогноза важна оценка чувствительности к терапии после проведения индукционного курса. Окончательную оценку, согласно большинству протоколов, проводят после двух курсов лечения.
Постремиссионная терапия должна состоять не менее чем из трёх блоков. Это может быть только химиотерапия или химиотерапия с последующей аутологичной или аллогенной трансплантацией гемопоэтических стволовых клеток. Некоторые терапевтические режимы включают поддерживающую терапию. Важный элемент – профилактика и лечение поражений ЦНС путём интратекального введения цитостатических препаратов, системной высокодознои терапии, а иногда и краниального облучения. Основной препарат для интратекальной терапии при остром миелобластном лейкозе – цитозин-арабинозид, в некоторых протоколах дополнительно используют преднизолон и метотрексат.
Современная терапия острою миелобластного лейкоза должна быть дифференцированной, т.е. различной по интенсивности (а значит, и по токсичности) в зависимости от группы риска. Кроме того, лечение должно быть настолько специфичным, насколько это возможно.
Терапия индукции
Цитотоксическая терапия острого миелобластного лейкоза вызывает транзиторную, но тяжёлую миелосупрессию с высоким риском инфекций и геморрагических осложнений. Спектр цитостатических препаратов, эффективных в отношении острого миелобластного лейкоза, достаточно невелик. Базовые препараты – цитозин-арабинозид, антрациклины (даунорубицин, митоксантрон, идарубицин), этопозид, тиогуанин.
Классически индукцию ремиссии острого миелобластного лейкоза проводят семидневным курсом. В течение всех 7 дней пациент получает цитозин-арабинозид в дозе 100-200 мг/(м 2 хсут), который в течение трёх дней комбинируют с даунорубицином в дозе 45-60 мг/(м 2 хсут). Большинство протоколов основано на этой классической схеме «7+3», к которой могут быть добавлены тиогуанин, этопозид или другие препараты. При применении таких терапевтических схем ремиссии достигают у 90% больных.
В 1989-1993 годах группа CCG провела исследование 589 детей с острым миелобластным лейкозом. Исследование показало преимущество индукции в режиме интенсивного тайминга. Суть этого режима в том, что больные получают индукционную терапию, состоящую из двух одинаковых 4-дневных курсов с интервалом 6 дней. Каждый курс лечения включает цитозин-арабинозид, даунорубицин, этопозид и тиогуанин. Необходимость повторения курса лечения строго через фиксированный интервал, независимо от показателей гемопоэза, обусловлена тем, что леикемические клетки, которые находились во время первого курса вне митотической фазы, войдут в неё ко времени начала второго курса и подвергнутся цитотоксическому воздействию химиопрепаратов. Преимущество интенсивного тайминга в достоверном увеличении EFSc 27% у больных, получавших ту же терапию в стандартном режиме, до 42%. В настоящее время группа CCG опубликовала данные о пилотном исследовании индукции интенсивного тайминга с использованием идарубицина, показаны преимущества этого препарата в терапии индукции у детей.
Группа MRC в исследовании AML-9 (1986 год) показала преимущества продлённой терапии индукции (5-дневную индукцию с применением даунорубицина, цитозин-арабинозида и тиогуанина сравнивали с 10-дневной). Несмотря на более высокий уровень смертности от токсичности (21 против 16%), уровень достижения ремиссии был выше в группе продлённой терапии. Следующее исследование этой группы – AML-10 – включало 341 ребёнка. Индукционная терапия в AML-10 была основана на стандартных дозах цитозин-арабинозида и даунорубицина с добавлением трегьего препарата – этопозида или тиогуанина, в зависимости от группы рандомизации. Индукция в AML-12 (в исследование включены 529 детей) состояла из схемы ADE (цитозин-арабинозид + даунорубицин + этопозид), в другой группе рандомизации – из схемы АМЕ (цитозин-арабинозид + митоксантрон + этопозид). Ремиссия в обоих исследованиях составила 92%, смерть в индукции и резистентные острые миелобластные лейкозы – по 4%. Уровень ремиссии в обеих ветвях протокола AML-12 (ADE и АМЕ) был практически одинаковым – 90 и 92%. В начале 1990-х годов DFS при остром миелобластном лейкозе увеличилась с 30 до 50%; с 1995 года (протокол AML-12) значение данного показателя составляет 66%.
Индукция по протоколу исследовательской группы LAME состоит из стандартных доз цитозин-арабинозида и митоксантрона (суммарная доза 60 мг/м 2 ), ремиссия достигнута у 90% больных.
В России наиболее хорошо известны протоколы группы BFM. До 1993 года индукционная терапия состояла из курса ADE (цитозин-арабинозид + даунорубицин + этопозид). Согласно протоколу AML-BFM-93 (исследование включает 471 ребёнка), индукционная терапия в одной группе рандомизации была прежней – ADE, в другой группе – состояла из цитозин-арабинозида, этопозида и идарубицина. Уровень достижения ремиссии среди всех пациентов составил 82,2%. Показано, что введение идарубицина достоверно увеличило редукцию бластов у пациентов к 15-му дню от начала индукционной терапии, однако это не повлияло на частоту досгижения ремиссии и DFS, которая в этих группах была сходной.
Постиндукционная терапия
Большинство протоколов в качестве постремиссионной терапии предполагает два или более курса цитостатиков. Как правило, не менее одного курса полихимиотерапии основано на высоких дозах цитозин-арабинозида (1-3 г/м 2 в одно введение). Дополнительные препараты – этопозид и/или антрациклины (идарубицин или митоксантрон).
Наиболее успешны протоколы, предусматривающие три постремиссионных блока химиотерапии, часть которых проводят в режиме интенсивного тайминга и/или с использованием высоких доз цитозин-арабинозида.
Трансплантация гемопоэтических стволовых клеток
Современная терапия острого миелобластного лейкоза предусматривает для определённых категорий пациентов трансплантацию гемопоэтических стволовых клеток (ТГСК). Существуют два принципиально различных вида трансплантации – аллогенная и аутологичная.
Аллогенная трансплантация гемопоэтических стволовых клеток – эффективный, но высокотоксичный метод антилейкемическои терапии. Антилеикемический эффект алло-ТТСК обеспечивается кондиционированием с аблативной химиотерапией и иммунологическим эффектом «трансплантат против лейкемии» – оборотной стороной синдрома «трансплантат против хозяина». С 1990 года отмечено улучшение результатов терапии у детей, получивших стандартную индукцию ремиссии, основанную на применении цитозин-арабинозида и антрациклинов, консолидирующую терапию и, при наличии родственного HLA-идентичного донора, аллогенную ТГСК. Аллогенная трансплантация гемопоэтических стволовых клеток – наиболее эффективный метод профилактики рецидива, однако в первую ремиссию острого миелобластного лейкоза он показан только пациентам из группы высокого риска.
По сравнению с аллогенной, роль аутологичной трансплантации в профилактике рецидива не столь очевидна.
Терапия острого промиелоцитарного лейкоза
Вариант М, по ЕАВ – особый вид острого миелолейкоза. Его регистрируют во всех регионах мира, но в некоторых он существенно преобладает. Среди всех случаев острого миелобластного лейкоза в США и Европе на острый промиелоцитарный лейкоз приходится 10-15%, в то время как в Китае – около трети, а среди латиноамериканской популяции – до 46%. Основное звено патогенеза и диагностический признак острого промиелоцитарного лейкоза – транслокация t(15;17)(q22;ql2) с образованием химерного гена PML-RARa. В клинической картине лидирует коагулопатия (в равной степени вероятны ДВС и гиперфибринолиз), которая может усугубляться на фоне химиотерапии, формируя высокий уровень смертности от геморрагического синдрома в начале лечения (20%). Неблагоприятные в отношении прогноза факторы – инициальный лейкоцитоз (количество лейкоцитов превышает 10х10 9 /л) и экспрессия CD56 на лейкемических промиелоцитах.
В течение последних 20 лет прогноз для пациентов с острым промиелоцитар-ным лейкозом изменился с «фатального в высокой вероятности» на «выздоровление в высокой вероятности». Наибольший вклад в эти перемены внесло введение в терапию all-транс-ретиноевой кислоты (ATRA). ATRA – патогномоничный дифференцирующий агент, подавляющий транскрипцию PML-RARa, обрывающий путь леикемогенеза и инициирующий дозревание атипичных промиелоцитов до гранулоцитов in vivo и in vitro. Применение ATRA в индукции позволяет достичь ремиссии у 80-90% пациентов с развившимся de novo острым промиелоцитарным лейкозом. ATRA нивелирует проявления коагулопатии и не вызывает аплазии кроветворения, что снижает вероятность кровотечений и сепсиса в раннем периоде лечения. Стандартная доза ATRA 45 мг/(м 2 хсут). Показана возможность снижения дозы препарата без изменения эффективности.
Большинству пациентов для достижения ремиссии достаточно применения ATRA в качестве монотерапии, однако без дополнительной терапии заболевание практически всегда рецидивирует в течение первого полугодия. Наилучшая стратегия – комбинирование ATRA с индукционной химиотерапией. Показано, что индукция с использованием all-трансретиноевой кислоты в комбинации с антрациклинами, несколько курсов основанной на антрациклинах консолидации и поддерживающая низкодозная терапия с или без ATRA обеспечивает 75-85% EFS в течение 5 лет у взрослых. Применение ATRA в индукции одновременно с химиотерапией даёт более высокую безрецидивную выживаемость, чем последовательное использование препаратов. Применение поддерживающей терапии также уменьшает вероятность рецидива, а увеличение дозы антрациклинов в индукционной терапии и ATRA в консолидации может улучшить результаты лечения больных группы риска.
Результаты исследований эффективности лечения острого промиелоцитарного лейкоза у детей до настоящего времени не опубликованы, однако природа заболевания и принципы терапии одинаковы во всех возрастных группах.
Какой прогноз имеет острый миелобластный лейкоз?
Современные представления о прогнозе острого миелобластного лейкоза выглядят следующим образом: в группе «хороший прогноз» вероятность 5-летней выживаемости составляет 70% и более, вероятность рецидива меньше 25%; в группе «промежуточній прогноз» выживаемость составляет 40-50%, рецидив возникает у 50% пациентов; категория «плохой прогноз» характеризуется высокой вероятностью рецидива (более 70%) и низкой вероятностью 5-летней выживаемости – менее 25%.